ЭДС поляризации и электродная поляризация
Экспериментально установлено, что ЭДС гальванического элемента, находящегося под током, отличается от ЭДС в условиях, когда ток в электрохимической системе отсутствует.
Принято различать электрохимические системы, являющиеся источником работы (для них сохраняется название гальванический элемент), и системы, потребляющие электрическую работу извне для проведения химической реакции (такие системы называют гальванической ванной).
Обозначим ЭДС электрохимической системы, работающей в квазистатических условиях (при отсутствии тока) Er, а ЭДС системы, по которой протекает ток, обозначим EI .
Экспериментальные данные показывают, что выполняются соотношения:
Er > EI для гальванического элемента, (6 - 1)
Er < EI для гальванической ванны. (6 - 2)
Попытки объяснить различия между двумя значениями ЭДС падением разности потенциала Eom за счет внутреннего сопротивления системы R (при условии, что Eom =IR) оказались безуспешными.
Пренебрегая омическим сопротивлением системы, для сохранения равенства можно записать:
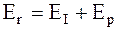 . (6 - 3)
. (6 - 3)
Величина Ер, вводимая равенством (6 - 3), называется ЭДС поляризации.
Подобно равновесной ЭДС гальванической цепи Er, равной разности электродных потенциалов (Er = jп - jл, где jп и jл - потенциалы правого и левого электродов), ЭДС поляризации также представляет собой разность двух величин, которые относятся к отдельным электродам:
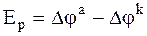 . (6 - 4)
. (6 - 4)
Входящие в уравнение (6 - 4) величины называются электродной поляризацией, причем Dja относится к аноду, являющемуся правым электродом, а Djk - к катоду, являющемуся левым электродом. Djk называется катодной поляризациейи Dja - анодной поляризацией.
Из соотношения (6 - 1) следует, что для гальванического элемента ЭДС поляризации всегда больше 0. Это означает, что должны выполняться условия:
Djk < 0; (6 - 5)
Djа > 0. (6 - 6)
Если обозначить потенциалы электродов, находящихся под током - jIa и jIk, а равновесные потенциалы - jra и jrk, то соответственно для катодной и анодной поляризации получим:
jIk - jrk = Djk < 0; jIk < jrk; (6 - 7)
jIa - jrk = Dja > 0; jIa > jrk. (6 - 8)
Таким образом, потенциал катода под током уменьшается по сравнению с равновесным значением, а потенциал анода увеличивается.
Дата добавления: 2015-07-22; просмотров: 3259;
