Электрическая проводимость растворов электролитов
Для описания электрических свойств растворов электролитов исходным понятием служит удельная проводимостьk, представляющая собой величину, обратную удельному сопротивлению, т.е. сопротивлению проводника с площадью сечения 1м2 и длиной 1 м:
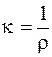 .
.
Удельная проводимость раствора электролита зависит от подвижностей ионов. Эту зависимость для бинарного электролита можно установить следующим образом.
Мысленно вырежем в объеме раствора электролита параллелепипед с площадью сечения 1 м2, разделяющийся боковыми ребрами на две части с длинами, равными абсолютным подвижностям катионов U0,+ и анионов U0,−. Таким образом, сечение делит параллелепипед на две части с объемами U0,+ и U0,−. Если ребра расположены вдоль линии тока, то за 1с все катионы из объема U0,+ и анионы из объема U0,− пройдут через сечение. Рассчитаем, какой заряд они перенесут через это сечение.
Пусть молярная концентрация электролита равна СM, заряды ионов равны по абсолютной величине z. Тогда заряд катионов, содержащихся в объеме U0,+ и анионов в объеме U0,−, равен
zFСM(U0,+ + U0,−).
Так как этот заряд переносится через сечение за 1с, то он равен силе тока, проходящего через единичную площадь сечения при градиенте потенциала Dj /l. По закону Ома для единичного сечения получим:
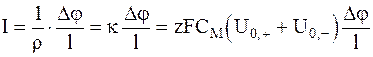
или
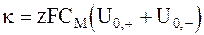 . (5 - 25)
. (5 - 25)
Чтобы оценить особенности данного электролита, в электрохимии используют понятие эквивалентной проводимости электролита L, которая представляет собой отношение удельной проводимости к нормальной концентрации (нормальности) раствора электролита СN. С учетом уравнения (5 - 25) получим:
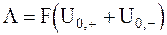 . (5 - 26)
. (5 - 26)
Произведение абсолютной подвижности иона на постоянную Фарадея называют ионными проводимостямиили относительными ионными подвижностями:
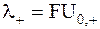 ;
;
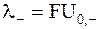 .
.
Следовательно, для полностью диссоциирующего электролита выполняется равенство:
L = l+ + l−. (5 - 27)
Уравнение (5 - 27) получено для сильных электролитов или предельно разбавленных растворов слабых электролитов. Для растворов слабых электролитов средних концентраций необходимо ввести поправку на степень диссоциации a:
L = a(l+ + l−). (5 - 28)
Обозначив эквивалентную проводимость предельно разбавленного электролита L0 (ей соответствует полная диссоциация электролита, a=1), получим
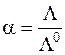 ,
,
и, используя закон действия масс, выразим константу диссоциации бинарного электролита через его эквивалентную проводимость:
 . (5 - 29)
. (5 - 29)
Соотношение (5 - 29) является вариантом широко известного закона разбавления Оствальда.
В достаточно концентрированных растворах сильных электролитов в значительной мере начинают проявляться межионные взаимодействия. Согласно теории Дебая - Хюккеля можно принять, что каждый ион находится в центре ионной атмосферы. Влияние ионной атмосферы на подвижность отдельных ионов и проводимость растворов можно представить следующим образом.
При отсутствии внешнего поля тонная атмосфера не влияет заметно на тепловое движение центрального иона. Однако при наложении внешнего электрического поля происходит миграция центрального иона и противоположно заряженных ионов атмосферы в противоположных направлениях. Ионная атмосфера движется вместе со слоями воды, окружающими входящие в нее ионы, и движение центрального иона в противоположном направлении замедляется. Это явление получило название электрофоретического эффекта.
Еще одной причиной торможения центрального иона является смещение электрического центра тяжести ионной атмосферы относительно центрального иона, в результате чего движущаяся в противоположном направлении ионная атмосфера начинает подтягивать к себе за счет электростатического взаимодействия центральный ион. Такое торможение центрального иона называется релаксационным эффектом.
Теория Дебая - Хюккеля, положенная в основу методов расчета термодинамической активности электролитов и объяснившая особенности влияния концентрации электролитов на их проводимость, получила экспериментальное подтверждение в виде эффекта Дебая - Фалькенхагена и эффекта Вина.
Эффект Дебая - Фалькенхагеназаключается в повышении проводимости растворов сильных электролитов при высоких частотах переменного тока (> 106 Гц). Это явление, называемое также частотной дисперсией проводимости, Дебай и Фалькенхаген объяснили тем, что при высоких частотах центральный ион колеблется в центре ионной атмосферы и релаксационный эффект не возникает. Как и следовало ожидать в соответствии с моделью Дебая - Хюккеля, с повышением концентрации электролита и заряда ионов критическая частота, при которой начинает проявляться дисперсия проводимости, также возрастает.
Вин обнаружил, что при больших напряженностях электрического поля (> 106 В/м) проводимость растворов электролитов возрастает. Это явление, называемое эффектом Вина, объясняется тем, что при быстром движении ионов ионная атмосфера не успевает выстраиваться.
Для выяснения роли отдельных ионов в переносе заряда используется уже упоминавшееся понятие - число переноса иона (более точное название - электрическое число переноса данного иона).
Для бинарного электролита выполняется условие:
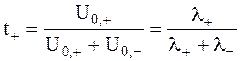 и
и 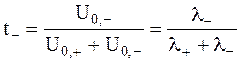 .
.
Существует несколько методов определения чисел переноса.
Если ионы окрашены, то можно определять скорость их движения визуально по смещению границы, а затем использовать эти данные для расчета чисел переноса. Для оценки скорости перемещения границы между двумя растворами используют также химико-аналитические методы. Можно определять изменение концентрации ионов в приэлектродном пространстве при прохождении через раствор заданного количества электричества и использовать эти данные для расчета чисел переноса. Кроме того, для расчета чисел переноса можно использовать данные по определению диффузионного потенциала.
Дата добавления: 2015-07-22; просмотров: 1014;
