Экспериментальные данные по коэффициентам активности
Зависимость среднего коэффициента активности от моляльности раствора некоторых электролитов показана на рис. 4 ‑ 1.
 Как видно из рисунка, вначале с ростом концентрации раствора коэффициент активности всех электролитов уменьшается. Затем у большей части электролитов наблюдается рост коэффициента активности с повышением концентрации раствора. Для 1,1-валентных солей возрастание активности обычно происходит, начиная с моляльности раствора от 0,6 до 1,2 моль/кг. Однако этот диапазон концентраций является условным. В частности, минимуму коэффициента активности для KCl отвечает 2,5, а для CsCl - 4,5 моль/кг. Коэффициент активности нитратов и хлоратов монотонно уменьшается с повышением концентрации и минимум коэффициента активности отсутствует. В растворах кислот и оснований положение минимума соответствует меньшим концентрациям по сравнению с солями. Например, для HCl моляльность минимума коэффициента активности равна 0,4, для HBr - 0,3, для HI - 0,2 моль/кг.
Как видно из рисунка, вначале с ростом концентрации раствора коэффициент активности всех электролитов уменьшается. Затем у большей части электролитов наблюдается рост коэффициента активности с повышением концентрации раствора. Для 1,1-валентных солей возрастание активности обычно происходит, начиная с моляльности раствора от 0,6 до 1,2 моль/кг. Однако этот диапазон концентраций является условным. В частности, минимуму коэффициента активности для KCl отвечает 2,5, а для CsCl - 4,5 моль/кг. Коэффициент активности нитратов и хлоратов монотонно уменьшается с повышением концентрации и минимум коэффициента активности отсутствует. В растворах кислот и оснований положение минимума соответствует меньшим концентрациям по сравнению с солями. Например, для HCl моляльность минимума коэффициента активности равна 0,4, для HBr - 0,3, для HI - 0,2 моль/кг.
В растворах электролитов типа 2,1 минимум коэффициента активности обычно проявляется при меньших концентрациях, чем у электролитов типа 1,1.
Для электролитов типа 1,2 характерно почти монотонное понижение коэффициента активности с ростом концентрации.
Зависимость коэффициента активности от концентрации в области малых концентраций (до 0,05 моль/л) соответствует уравнению, предлагаемому теорией Дебая - Хюккеля в форме:
 . (4 - 16)
. (4 - 16)
В области более высоких концентраций первое приближение теории Дебая - Хюккеля приводит к результатам, отклоняющимся от экспериментальных данных. В связи с этим Дебай и Хюккель во втором приближении учли собственные размеры ионов.
Второе приближение теории Дебая - Хюккеля приводит к уравнению:
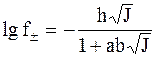 , (4 - 17)
, (4 - 17)
где а - усредненный радиус ионов, 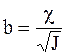 (c - толщина ионной атмосферы).
(c - толщина ионной атмосферы).
В дальнейшем Хюккель и другие исследователи предложили ряд полуэмпирических и эмпирических уравнений, отражающих зависимость коэффициента активности от концентрации.
Дата добавления: 2015-07-22; просмотров: 797;
