Связанные с почечной недостаточностью 3 страница
Многие стороны действия тиазидов у здоровых лиц и больных с гиперпаратиреозом остаются неясными. Хроническое введение тиазидов приводит к уменьшению экскреции кальция с мочой. При гипопаратиреозе это нельзя объяснить усилением биологического действия ПТГ. В то же время эти соединения отчетливо усиливают реакцию костей и почечных канальцев на ПТГ. Гипокальциурический эффект тиазидов отражает, по-видимому, усиленную реабсорбцию натрия и кальция в почечных канальцах в ответ на снижение содержания натрия и более выражены у лиц с сохраненной секрецией паратиреоидного гормона, будь то нормальной или повышенной. Тем не менее заметной гипокальциурический эффект у больных с гипопаратиреозом, получающих высокие дозы витамина D или пероральные добавки кальция, оправдывает применение тиазидов в качестве дополнительного средства лечения таких больных.
Интоксикация витамином А. Иногда, хотя и редко, причиной гиперкальциемии служит интоксикация витамином А. Большинство таких случаев — это результат экспериментов с пищевыми добавками. При приеме 50 000—100 000 ЕД витамина А в сутки (что в 10—20 раз выше суточных потребностей) содержание кальция может возрастать до 12— 14 мг/100 мл (120—140 мг/л). У больных возникают типичные проявления тяжелой гиперкальциемии — утомляемость и анорексия. Появляются также сильные боли в мышцах и иногда разлитые боли в костях. Предполагают, что избыток витамина А усиливает резорбцию костей.
Диагноз можно установить по анамнезу и путем повторных определений содержания витамина А в сыворотке, который может в несколько раз превышать норму. При рентгеноскопии скелета иногда обнаруживают периостальные кальцификаты, особенно в верхних конечностях. Отмена витамина обычно сопровождается быстрым исчезновением гиперкальциемии и изменений скелета. Как и при интоксикации витамином D, введение в 100 мг в сутки гидрокортизона или его эквивалента приводит к быстрой нормализации уровня кальция в сыворотке крови.
Гиперкальциемия, связанная с почечной недостаточностью
Тяжелый вторичный гиперпаратиреоз. Вторичный гиперпаратиреоз — это состояние, при котором избыточная продукция ПТГ обусловливается частичной резистентностью к метаболическим эффектам гормона. Околощитовидные железы увеличиваются и секретируют повышенное количество ПТГ потому, что из-за резистентности к нормальному содержанию гормона развивается гипокальциемия, которая в свою очередь служит стимулом к гиперплазии околощитовидных желез. Это представление основано на результатах экспериментов на животных (в условиях экспериментальной почечной недостаточности с задержкой фосфата) и наблюдений за больными, получающими дифосфонаты, которые остро блокируют резорбтивную реакцию кости. Последствия этих сдвигов проиллюстрированы на рис. 336-1, а и б. При оценке секреторного резерва околощитовидных желез путем намеренного снижения уровня кальция в кровь степень повышения концентрации ПТГ на каждый мг/100 мл падения кальция плазмы в условиях гиперплазии околощитовидных желез оказывается большей, чем при нормальных железах. Поэтому при любой данной концентрации кальция уровень гормона выше, чем в норме. Поскольку при любом повышении концентрации кальция в крови какая-то часть секреции ПТГ каждой отдельной паратиреоидной клеткой сохраняется, более крупные железы (больше клеток) обеспечивают выброс большего количества гормона на гиперкальциемическом отрезке кривой доза—реакция.
Вторичный гиперпаратиреоз развивается у больных с почечной недостаточностью, остеомаляцией (дефицит витамина D) и псевдогипопаратиреозом (снижение реакции на ПТГ на уровне рецепторов). Клинические проявления вторичного гиперпаратиреоза при этих состояниях различны. Однако общей причиной вторичного гиперпаратиреоза остается гипокальциемия. Первичный и вторичный гиперпаратиреоз различаются тем, что в первом случае увеличение околощитовидных желез (вероятно, необратимое) происходит автономно, а во втором — как адаптивная реакция (вероятно, обратимая). Действительно, после лечения дифосфонатом наблюдается нормализация секреции ПТГ, сопровождающаяся, по-видимому, уменьшением массы околощитовидных желез до нормы (см. рис. 336-1, б).
Начальная тенденция к гипокальциемии при прогрессирующей патологии почек объясняется, очевидно, двумя причинами: задержкой фосфата из-за снижения способности почек экскретировать его и снижением концентрации 1,25(OH)2D, которое сопровождает прогрессирующее поражение почек. Эти два механизма обусловливают снижение чувствительности костной ткани к ПТГ. Дефицит 1,25(OH)2D ограничивает также всасывание кальция из кишечника, которое и без того при уремии нарушено. Конечные патофизиологические последствия хронической почечной недостаточности складываются из разнонаправленных эффектов стимулов к гиперплазии околощитовидных желез и факторов, модифицируемых чувствительность органов-мишеней (костей, кишечника и сохранившихся почечных канальцев) к паратиреоидному гормону. Развитие вторичного гиперпаратиреоза должно отражать нарушение баланса между повышенной скоростью секреции ПТГ из-за гиперплазии околощитовидных желез и восстановлением нормальной чувствительности к периферическому действию гормона. У небольшого числа больных с тяжелым вторичным гиперпаратиреозом развиваются гиперкальциемия и гиперфосфатемия вследствие острого усиления костной резорбции; гиперсекреция ПТГ «перевешивает» степень резистентности к гормональному эффекту.
Кроме гиперкальциемии и гиперфосфатемии, у больных могут появляться боли в костях, эктопическая кальцификация и зуд. Поражение костей при вторичном гиперпаратиреозе и почечной недостаточности обычно называют почечной остеодистрофией. Иногда наблюдаются сопутствующая остеомаляция (недостаточность витамина D) и кистозно-фиброзный остеит (чрезмерный эффект ПТГ). Действительно, кистозно-фиброзный остеит при нелеченой почечной недостаточности встречается в настоящее время чаще, чем при первичном гиперпаратиреозе.
Разумное консервативное лечение, направленное на снижение повышенного уровня фосфата в крови путем ограничения его потребления с пищей в сочетании с применением невсасывающихся антацидов и осторожным выборочным добавлением витамина D (в виде кальцитриола по 0,25—2 мкг в сутки), может привести к смягчению тяжелого вторичного гиперпаратиреоза. Несколько парадоксальный факт заключается в том, что уровни кальция и фосфата в сыворотке могут нормализоваться, несмотря на введение повышенных количеств метаболита витамина D и кальциевые добавки. Как показано на рис. 336-1, б, предположительно происходит инволюция околощитовидных желез с уменьшением клеточной массы, вследствие чего усиленный секреторный ответ возвращается к норме. Уровень ПТГ при любой данной концентрации кальция в крови становится более адекватным, и чрезмерное его действие прекращается.
Интоксикация алюминием. Интоксикация алюминием встречается среди больных, находящихся на хроническом диализе, и проявляется острой деменцией, не поддающейся лечению тяжелой остеомаляцией, болями в костях, множественными незаживающими переломами, особенно ребер и тазовых костей, и проксимальной миопатией. При лечении этих больных так же, как лиц с почечной остеодистрофией и почечной недостаточностью (введение витамина D или кальцитриола) развивается гиперкальциемия. Острая гиперкальциемия под действием витамина D возникает, очевидно, из-за изменения реактивности скелета. В участках минерализации остеоида появляется алюминий и активность остеобластов значительно снижается. Полагают, что у таких больных отсутствует способность включать в костную ткань повышенное количество кальция крови. Профилактика сводится к удалению избытка алюминия при диализе. Лечение предусматривает мобилизацию алюминия путем использования хелирующего агента—дефероксамина. Алюминий выводится из костей и, будучи прочно связанным с хелирующим агентом, может быть удален с помощью диализа. После ликвидации алюминиевого токсикоза у больных иногда отмечаются типичные признаки почечной остеодистрофии и вторичного гиперпаратиреоза. Если описанный синдром остается недиагностированным, развивается инвалидность из-за поражения костей, причем прогрессирующие переломы или гиперкальциемия, связанная с ошибочным назначением витамина D, может привести к смерти.
Молочно-щелочной синдром. Клинические проявления молочно-щелочного синдрома различны: острые, подострые и хронические, и характеризуются гиперкальциемией, алкалозом и почечной недостаточностью. Синдром обусловливается избыточным потреблением кальция и всасывающихся антацидов, например молока или соды. После появления таких противоязвенных средств, как невсасывающиеся антациды и антагонисты Н-2-рецепторов (циметидин и ранитидин), это нарушение встречается реже.
В патогенезе заболевания существенную роль играет индивидуальная восприимчивость, так как у многих больных, принимающих карбонат кальция, этот синдром не развивается. Одна из важных переменных — это фракционное всасывание кальция как функция его потребления. У некоторых лиц всасывается значительное количество потребляемого кальция, даже если в сутки в организм попадает около 2 г элементарного кальция и выше, т. е. не наблюдается снижения его всасывания при высоком потреблении, как это имеет место у большинства здоровых лиц. Возникающая в таких случаях легкая гиперкальциемия после еды может иметь основное значение в генезе алкалоза. У большинства людей после приема больших количеств не содержащих кальций щелочей, таких как бикарбонат натрия, алкалоз не развивается. Однако на фоне гиперкальциемии наблюдаются легкое повышение экскреции натрия и некоторое уменьшение общего количества воды в организме. Этот феномен в сочетании, вероятно, с некоторым снижением эндогенной секреции ПТГ должен был бы приводить к повышению реабсорбции бикарбоната. Задержка же бикарбоната на фоне продолжающегося потребления карбоната кальция приводила бы к развитию алкалоза. Сам по себе алкалоз сопровождается избирательным повышением реабсорбции кальция в дистальных отделах нефрона, что усиливает гиперкальциемию. Таким образом формируется цикл: легкая гиперкальциемия задержка бикарбоната алкалоз задержка кальция почками тяжелая гиперкальциемия. В результате степень гиперкальциемии и алкалоза нарастает до тех пор, пока продолжается прием кальция и всасываемых щелочей.
Острые гиперкальциемия и алкалоз, развивающиеся через несколько дней после начала потребления кальция и щелочей (острый молочно-щелочной синдром), проявляются слабостью, миалгией, раздражительностью и апатией. После прекращения приема кальция и щелочей нарушения функции почек, включая снижение их способности концентрировать мочу, дисфункция канальцев, а также гиперкальциемия и алкалоз быстро исчезают.
Запущенный молочно-щелочной синдром, иногда называемый синдромом Бернетта, представляет собой результат длительного потребления кальция и щелочей. Тяжелая гиперкальциемия, необратимая почечная недостаточность и задержка фосфата могут сопровождаться эктопической кальцификацией. При уменьшении приема кальция и щелочей наблюдается некоторое улучшение, но до внедрения методики диализа почечная недостаточность приводила к смерти. Существует также интермиттирующая, или подострая, форма синдрома, при которой отмена избыточного потребления кальция и щелочей обеспечивает нормализацию функции почек через несколько недель.
Дифференциальная диагностика: специальные тесты
Дифференциальную диагностику гиперкальциемических состояний лучше всего обеспечивают клинические критерии (рис. 336-2 и табл. 336-3). Лабораторные тесты, если одновременно производить не один, а несколько, приносят пользу, но каждый из них в отдельности обладает недостаточной чувствительностью и/или специфичностью. Правильной диагностике особенно помогает учет наличия или отсутствия симптомов, а также длительности заболевания. У больных с бессимптомной гиперкальциемией (если не считать широко распространенных среди населения утомляемости и депрессии) более чем в 90% случаев имеется первичный гиперпаратиреоз. Если гиперкальциемия связана с раком, то, как правило, имеется онкологическая симптоматика. Все другие причины, кроме гиперпаратиреоза и рака, определяют не более 10% случаев гиперкальциемии, причем некоторые непаратиреоидные причины имеют специфические проявления, например почечная недостаточность, признаки и симптомы которой выявляются уже при первом обычном лабораторном исследовании.
Вторым важнейшим клиническим ориентиром служит длительность состояния. Если гиперкальциемия существует более года, то из числа ее причин можно исключить злокачественную опухоль. Отличительной особенностью гиперкальциемии, связанной со злокачественным ростом, является быстрота течения, в силу чего признаки и симптомы имеющейся опухоли появляются в пределах месяцев после первого обнаружения гиперкальциемии. У больных с хронической гиперкальциемией наиболее вероятен диагноз гиперпаратиреоза. Другие заболевания (например, саркоидоз) лишь в редких случаях бывают причиной хронической гиперкальциемии. Тщательный опрос относительно особенностей диеты и принимаемых лекарств часто позволяет с легкостью выявить интоксикацию витамина D или А или прием тиазидов.
Хотя клинические данные способствуют установлению правильного диагноза причин гиперкальциемии, диагностической ценностью обладают и соответствующие лабораторные тесты. Теоретически отличить гиперпаратиреоз от всех других причин гиперкальциемии можно путем радиоиммунологического определения ПТГ; при гиперпаратиреозе уровень иПТГ должен быть повышенным, несмотря на гиперкальциемию, а у больных с опухолевой гиперкальциемией и другими ее причинами (кроме связанных с первичным гиперпаратиреозом, таких как литиевая гиперкальциемия и семейная гипокальциурическая гиперкальциемия) он должен быть ниже нормы или даже не поддаваться определению. Следовало бы ожидать повышения уровня 1,25(OH)2D при первичном гиперпаратиреозе (как следствие увеличения содержания ПТГ), а также при интоксикации витамином D и саркоидозе. При других состояниях, сопровождающихся гиперкальциемией, уровень 1,25(OH)2D должен был бы быть сниженным или в лучшем случае нормальным. Однако столь четкие различия лабораторных показателей при дифференциальной диагностике гиперкальциемии не являются правилом.
Как отмечалось в гл. 335, присутствующий в крови иПТГ гетерогенен. Поэтому с помощью разных методов не всегда определяется одно и то же вещество. Это зависит от участка молекулы, распознаваемого разными антисыворотками к гормону. Действительно, при почечной недостаточности может возрастать концентрация фрагментов ПТГ, что не означает соответствующего повышения уровня биологически активного интактного гормона.
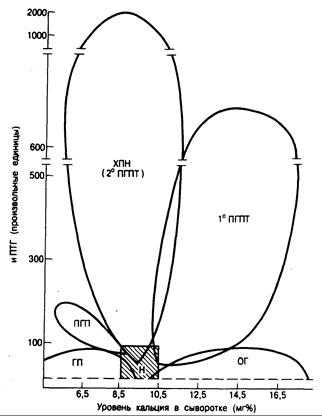
Рис. 336-2. Схематическое изображение результатов одновременного определения уровня иммунореактивного паратиреоидного гормона (иПТГ) и кальция в сыворотке у здоровых людей (Н), больных с опухолевой гиперкальциемией (ОГ), гипопаратиреозом (ГП), псевдогипопаратиреозом (ПГП), хронической почечной недостаточностью и вторичным гиперпаратиреозом (ХПН) и первичным гиперпаратиреозом (ПГПТ).
Указаны пределы колебаний показателей, типичные для больных каждой группы. Следует обратить внимание на взаимопроникновение разных областей и разрывы в оси ординат (см. текст).
Как показано на рис. 336-2, результаты радиоиммунологического определения ПТГ в клинике легче всего интерпретировать с помощью ковариантного анализа [(иПТГ)•(Са2+)], помещая на графике уровни иПТГ (определяемые конкретным методом) у каждого больного против одновременно фиксируемой концентрации кальция с последующим сравнением индивидуальных результатов теста с оценкой клинических коррелятов. При таком графическом изображении прямоугольная область охватывает показатели, выявленные у многих здоровых (контрольных) лиц; по бокам эта область ограничивается верхними и нижними пределами колебаний уровня кальция в сыворотке, а снизу и сверху — нижним пределом чувствительности использованного метода и максимальной концентрацией иПТГ в норме.
Если при хирургически доказанном гиперпаратиреозе концентрация иПТГ оказывается ниже верхней границы нормы, то (особенно при совпадении результатов нескольких
Таблица 336-3. Дифференциальная диагностика гиперкальциемии: клинические критерии
| Заболевания | Кровь1 | Моча2 | |||||
| Са | Фн | 1,25 (OH)2D | иПТГ | НцАМФ2 | Са | МРФ/ СКФ | |
| Первичный гиперпаратиреоз | | | | [] | | , | |
| Гиперкальциемия,связанная со злокачественным ростом: гуморально опосредованная | | | , | , | | | |
| локальная деструкция (остеолитические метастазы) | | | | | | | |
1 В скобках показаны редко наблюдаемые при данном заболевании сдвиги. 2 Данные об уровне циклического АМФ при злокачественных опухолях сильно варьируют
(, , ) независимо от системной или локальной опосредованности костной резорбции, и даже наличия или отсутствия гиперкальциемии.
Обозначения: Фн — неорганический фосфат, иПТГ — иммунореактивный паратиреоидный гормон, НцАМФ — нефрогенный циклический АМФ, МРФ — максимальная реабсорбция фосфата в почечных канальцах, СКФ — скорость клубочковой фильтрации. повторных определений) ее следует все же считать повышенной, так как в условиях нормальной чувствительности околощитовидных желез к гиперкальциемии иПТГ вообще не должен был бы определяться. Показатели, характерные для больных с различными видами гиперкальциемии, иногда перекрывают друг друга и особенно норму. С помощью некоторых методов при опухолевой гипергликемии обнаруживаются более высокие уровни ПТГ, чем показанные на рис. 336-2.
Методы, основанные на распознавании исключительно концевой части молекулы, позволяют обойти трудности, возникающие при определении 4фагментов. Однако, как правило, все радиоиммунологические методы определения ПТГ должны «работать» вблизи пределов определимости, чтобы охватить все цифры, обнаруживаемые у здоровых лиц. В таких условиях на результатах определения может сказываться влияние присутствующих в плазме факторов, особенно при почечной недостаточности и злокачественных заболеваниях. Именно это, по-видимому, объясняет многие ложноположительные и ложноотрицательные результаты. При определении 1,25(ОН)2D также можно столкнуться с методическими трудностями.
У некоторых больных с хирургически доказанным гиперпаратиреозом концентрации ПТГ находятся на верхней границе нормы (ложноотрицательные результаты иммунологических определений) (см. рис. 336-2). Концентрация гормона у больных с опухолевой гиперкальциемией, по данным большинства методов, нормальна или даже несколько повышена (ложноположительные результаты). Однако при той же степени повышения уровня кальция содержание иПТГ у них ниже, чем у больных с гиперпаратиреозом. Следовательно, чем тяжелее гиперкальциемия, тем большее значение приобретает иммунологическое определение паратиреоидного гормона для разграничения первичного гиперпаратиреоза и опухолевой гиперкальциемии. У таких больных уровни 1,25(OH)2D нормальны или снижены, что также отличает их от большинства больных с первичным гиперпаратиреозом, у которых они повышены.
При хронической почечной недостаточности содержание ПТГ повышено. Отчасти это отражает накопление фрагментов гормона вследствие почечной недостаточности, а не истинную гиперсекрецию околощитовидных желез, но отчасти определяется истинным вторичным гиперпаратиреозом. У больных с саркоидозом уровни иПТГ понижены или не поддаются определению. Для многих других причин гиперкальциемии, не связанной с паратиреоидным гормоном (см. табл. 336-1), данные систематических радиоиммунологических определений ПТГ отсутствуют. В основном это объясняется редкостью соответствующих заболеваний.
Таким образом, уровни иПТГ повышены более чем у 90% больных с гиперкальциемией, связанной с функцией околощитовидных желез; нормальны или умеренно повышены при опухолевой гиперкальциемии; повышены в разной степени (и поэтому, как правило, неинформативны) при гиперкальциемии, связанной с почечной недостаточностью: и нормальны или ниже пределов чувствительности метода при гиперкальциемии, связанной с витамином D и высоким кругооборотом костной ткани (хотя данные в отношении последних групп скудны).
Определение уровня нефрогенного циклического АМФ имеет ограниченное значение для разграничения двух основных причин гиперкальциемии — первичного гиперпаратиреоза и злокачественных новообразований. Высокое содержание нефрогенного циклического АМФ встречается у некоторых больных с опухолевой гиперкальциемией и практически у всех больных с первичным гиперпаратиреозом. Для подтверждения диагноза конкретного заболевания применяют и некоторые другие лабораторные тесты.
В табл. 336-3 суммированы лабораторные данные, характерные для первичного гиперпаратиреоза, злокачественных заболеваний с локальной деструкцией костной ткани (остеолитические метастазы) и опухолевой гиперкальциемии, связанной с выделением гуморальных факторов (псевдогиперпаратиреоз). Анализ приведенных данных в отношении иПТГ и 1,25(OH)2D показывает, что эти показатели не всегда позволяют четко отличить первичный гиперпаратиреоз от опухолевой гиперкальциемии. Однако в среднем содержание иПТГ при первичном гиперпаратиреозе повышено, а при опухолевой гиперкальциемии нормально; такие же результаты характерны и для содержания 1,25(OH)2D.
В отношении дифференциальной диагностики гиперкальциемии можно дать ряд рекомендаций. Если гиперкальциемия сопровождает какое-либо явное клиническое состояние, о котором известно, что оно вызывает это осложнение (см. табл. 336-1), то резонно предполагать, что именно это состояние служит причиной гиперкальциемии. При необходимости гиперкальциемию можно корригировать вначале общими мероприятиями, а подозреваемое заболевание лечить специфическими средствами. Если гиперкальциемия исчезает в ответ на специфическую терапию (как, например, при хирургическом лечении гиперпаратиреоза или уменьшении чрезмерного потребления жирорастворимых витаминов или щелочей и кальция в случае интоксикации витамином D или молочно-щелочном синдроме соответственно), то не нужно искать другие причины гиперкальциемии. Если специфическое лечение не приводит к исчезновению гиперкальциемии, следует искать другие причины, такие как первичный гиперпаратиреоз. Могут иметь место признаки злокачественного процесса, и с самого начала обследование должно быть сосредоточено на его выявлении.
Когда диагностические указания отсутствуют либо из-за бессимптомности случая, либо потому, что хроническое заболевание затушевывает симптомы и признаки, которые могли бы указывать на наличие опухоли, можно руководствоваться следующим. Если у больного нет симптомов и если гиперкальциемия имеет хронический характер, ее причиной почти наверняка служит гиперпаратиреоз. Если наряду с типичными проявлениями гиперпаратиреоза, описанными выше, при нескольких случайных определениях иПТГ обнаруживают повышенный его уровень, вряд ли необходимы какие-либо дополнительные исследования. Гиперпаратиреоз можно подтвердить только после того, как хирургическое удаление аномальной паратиреоидной ткани приведет к исчезновению гиперкальциемии. Больных же с бессимптомной гиперкальциемией, у которых на основании повышения концентраций иПТГ предполагают этот диагноз, можно просто наблюдать, как описано выше, или рекомендовать им операцию с достаточной уверенностью в успехе. Если у таких больных семейный анамнез свидетельствует о наличии других эндокринных расстройств, следует провести более тщательное обследование как самого больного, так и членов его семьи в поисках множественной эндокринной неоплазии.
Если у больного отсутствует четкая симптоматика и имеется очень короткий анамнез или вообще нет указаний на длительность существования гиперкальциемии, искать скрытую злокачественную опухоль необходимо более тщательно, чем при хронической гиперкальциемии. Даже в случае убедительного повышения уровня иПТГ у такого больного с отсутствием симптомов целесообразно, по-видимому, определить у него и содержания 1,25(OH)2D и при меньшей уверенности в диагнозе первичного гиперпаратиреоза продолжать наблюдение.
При наличии у больных общих симптомов и/или отсутствии повышения уровня иПТГ следует очень тщательно искать злокачественную опухоль, производя рентгенографию грудной клетки, компьютерную томографию грудной клетки и живота и сканирование скелета. Необходимо также обращать внимание на возможные признаки гематологических нарушений, такие как анемию, повышение содержание глобулинов в плазме и изменения иммуноэлектрофореграммы сыворотки; у больных с множественной миеломой результаты сканирования костей могут быть отрицательными. В отсутствие каких-либо признаков опухоли у больного может иметь место гиперпаратиреоз с сомнительным повышением уровня иПТГ, и со временем диагноз гиперпаратиреоза может стать более отчетливым.
Наконец, если у больного имеется бессимптомная хроническая гиперкальциемия, но уровень иПТГ не повышен, целесообразно направить поиски на другое хроническое заболевание, которое вызывает гиперкальциемию, но может иметь нетипичные проявления (например, скрытый саркоидоз).
Консервативное лечение при гиперкальциемии
Как правило, гиперкальциемию удается снять быстро. У большинства больных концентрацию кальция в сыворотке можно снизить на 3—9 мг/100 мл (30—90 мг/л) за 24—48 ч, что достаточно для ликвидации острых симптомов, предотвращения летального исхода от гиперкальциемического криза и выигрыша времени для проведения диагностических мероприятий. Однако хроническое консервативное лечение при гиперкальциемии обычно малоэффективно, если только не излечено основное заболевание, так как имеющиеся средства недоступны или токсичны.
Гиперкальциемия развивается потому, что из скелета высвобождается чрезмерное количество кальция, возрастает всасывание кальция в кишечнике или почки выводят недостаточное его количество. Выяснение патогенеза в каждом конкретном случае помогает планировать лечение. Например, гиперкальциемия у больных с остеолитическими метастазами или при острой иммобилизации обусловлена главным образом чрезмерным высвобождением кальция из скелета, и поэтому ограничение потребления кальция с пищей будет влиять на нее лишь в минимальной степени. С другой стороны, у больных с повышенной чувствительностью к витамину D или интоксикацией этим витамином резко усилено всасывание кальция в кишечнике, и в этих случаях ограничение кальция в диете окажется эф4эективным. Ослабление функции почек или уменьшение объема внеклеточной жидкости снижает экскрецию кальция с мочой. Если при этом имеются другие нарушения, такие как усиленный распад костной ткани, разовьется гиперкальциемия. Это может наблюдаться, например, в случае дегидратации у больных-с усиленной резорбцией костной ткани. В таких условиях регидратация может привести к быстрому исчезновению гиперкальциемии, несмотря даже на сохранение чрезмерной резорбции костей и повышенной экскреции кальция.
Гидратация, повышенный прием солей, легкий и форсированный диурез. Основой лечебных мероприятий является восстановление нормальной гидратации. У многих больных с гиперкальциемией происходит обезвоживание организма из-за рвоты, отказа от приема пищи и воды или вызываемого гиперкальциемией нарушения способности почек концентрировать мочу. Возникающее в результате падение скорости клубочковой фильтрации сопровождается дополнительным снижением клиренса натрия и кальция в почечных канальцах. Восстановление нормального объема внеклеточной жидкости корригирует эти сдвиги и увеличивает экскрецию кальция с мочой на 100—300 мг (2,5— 7,5 ммоль) в сутки. Усиление экскреции натрия с мочой до 400—500 мэкв в сутки увеличивает экскрецию кальция даже в большей степени, чем простая регидратация. Наконец, после полной реализации эффекта простого восполнения жидкости можно вводить солевой раствор или дважды в день давать обычные дозы фуросемида или этакриновой кислоты, чтобы ингибировать механизм канальцевой реабсорбции кальция (если только диуретики не будут вызывать обезвоживание). Сочетанное применение таких средств может привести к повышению экскреции кальция с мочой до 400 мг в сутки и выше у большинства больных с гиперкальциемией. Поскольку это составляет значительную долю общего пула обменивающегося кальция, его концентрация в сыворотке обычно падает на 1—3 мг/100 мл (10— 30 мг/л, 0,25—0,75 ммоль/л) за сутки. Сочетание приема жидкости (внутрь), натрия и фуросемида или этакриновой кислоты можно рекомендовать и для длительного амбулаторного лечения, используя при необходимости таблетки хлорида натрия. Необходимо контролировать концентрации калия и магния при длительном лечении и не допускать их снижения; потенциальным осложнением такой терапии являются кальциевые камни в почках.
Дата добавления: 2015-07-22; просмотров: 762;
