ГЛАВА 222. ИММУНОПАТОГЕНЕТИЧЕСКИЕ МЕХАНИЗМЫ ПОВРЕЖДЕНИЯ ПОЧЕК
Ричард Дж. Глэссок, Барри М. Бреннер (Richard J. Glassock, Barry M. Brenner)
Осознание важной роли аберрантных иммунных процессов в развитии поражения почек многих видов, особенно таких, которые затрагивают сосуды почечных клубочков, представляет один из самых значительных из достигнутых за последнюю четверть века концептуальных успехов в понимании сущности заболеваний почек. Хотя для многих из них уже выяснены конкретные детали этих патологических процессов, все еще имеются значительные пробелы в нашем понимании инициирующих событий и этиологических факторов, способствующих заболеванию почек.
В самом общем концептуальном плане иммунопатогенез повреждений почек можно упростить и свести его к нескольким фундаментальным механизмам, которые рассмотрены в гл. 62. Один из этих механизмов включает в себя реакцию циркулирующего в крови антитела с соответствующим ему почечным антигеном in situ. Этот антиген может быть или элементом, присущим самой почке, или же оказаться связанным с какой-то конкретной структурой почки в результате определенной биохимической или иммунологической реакции. Антигены, расположенные в базальных мембранах капилляров клубочков или почечных канальцев, и антитела к этим антигенам представляют собой важнейшие компоненты описываемого механизма. В настоящее время установлен целый ряд антигенных компонентов стенок капилляров клубочков и почечных канальцев. Как будет показано ниже, связывание циркулирующего в крови антитела с этими тканевыми антигенами приводит к возникновению нескольких характерных структурных изменений и иммуногистохимических проявлений. Иммунные процессы этой категории часто называют болезнями, вызванными-антитканевыми антителами.
Другой вид патогенетических процессов, намного более распространенный при заболеваниях почек у человека, включает в себя отложение внутри почечных структур (главным образом в клубочках) циркулирующих в крови макромолекулярных агрегатов, состоящих из антигенов и антител (т. е. циркулирующих в крови иммунных комплексов). Инициируемую этим механизмом болезнь называют болезнью, вызванной иммунными комплексами. При этом не требуется, чтобы иммунные комплексы обладали какими-либо специальными иммунохимическими взаимосвязями со структурами почек; таким образом, почки можно рассматривать как пассивного участника или «невиновную сторону», повреждаемую в результате процессов, начавшихся где-то в другом месте. Источник происхождения антигена может быть или эндогенным (аутологичным) или экзогенным (из окружающей среды). Кроме того, экзогенные антигены могут быть биологически инертными или вести свое происхождение от организмов, способных к самовоспроизведению (например, бактерий, вирусов и т. д.). При некоторых условиях экзогенные агенты могут также соединяться с аутологичными веществами, в результате чего образуются новые антигенные соединения (гаптен-протеиновые конъюгаты), которые взаимодействуют с антителами, образуя иммунные комплексы. В отличие от описанных выше механизмов, опосредуемые через клетки иммунные процессы менее определенно установлены в качестве возможных механизмов поражения клубочков и сосудов почек. И наконец, некоторые заболевания клубочков- у человека связаны с аномальной активацией альтернативного пути метаболизма системы комплемента.
Иммунопатогенетические механизмы. После того как иммунное повреждение произошло, оно опосредуется через взаимодействие ряда гуморальных и клеточных факторов. Активация системы комплемента может привести к прямому цитолизу клеточных компонентов клубочка или вызвать образование биологически активных фрагментов, способных повысить проницаемость сосудов или привлечь полиморфно-ядерные лейкоциты и другие клеточные компоненты. Свертывание может быть вызвано непосредственно изменениями эндотелиальной поверхности и прямым воздействием коллагенового матрикса, за которым следует локальная агрегация тромбоцитов. Виды взаимодействий системы комплемента и процесса свертывания крови многочисленны и сложны. Активация комплемента может положить начало процессу свертывания крови и наоборот. Активация фактора Хагемана (фактор XII) может стимулировать калликреин-кининовую систему. Таким образом могут быть высвобождены сильнодействующие вазоактивные пептиды, простагландины и лейкотриены, и все они могут играть определенную роль в локальных и системных изменениях гемодинамики, наблюдаемых в сочетании с иммунологически индуцированными заболеваниями почек. Полиморфно-ядерные лейкоциты, эозинофилы и моноциты (макрофаги), а также тромбоциты могут быть мобилизованы для разной степени участия в иммуноопосредуемом повреждении. Полиморфно-ядерные лейкоциты и моноциты, по-видимому, участвуют в повреждении клубочков благодаря способности этих клеток высвобождать локально факторы, способные повреждать ферментные гликопротеиды базальной мембраны, усиливая локальное образование токсичных окислов (гидроксильных радикалов и перекисных анионов). Активированные моноциты также могут играть роль связанного с мембраной прокоагулянта, способствуя таким образом отложению фибрина. Отложение тромбоцитов может участвовать в пролиферации клеток клубочков через высвобождение тромбоцитарного фактора роста или изменить анионный заряд стенки капилляров посредством локального высвобождения катионных протеидов, тем самым усиливая селективный характер изменившейся проницаемости клубочков. Суммарным результатом всех этих событий становится изменение структурной и функциональной целостности клубочковых капилляров и/или стенок околоканальцевых капилляров, что ведет к снижению фильтрационной способности, повышению селективной проницаемости для белков плазмы крови и способствует миграции клеточных элементов (например, эритроцитов и лейкоцитов) из внутрисосудистого пространства.
Повреждение почек, вызванное антитканевыми антителами. Болезнь, вызванная антителами к базальной мембране. Повреждение почек этого вида встречается у человека относительно редко, и на его долю приходится менее 5% всех случаев заболевания иммуноопосредованными гломерулонефритами. Посредством механизмов, сущность которых остается неясной, в циркулирующей крови появляются аутологичные антитела (обычно изотип IgG), которые направлены непосредственно на антигенные детерминанты неколлагеновых доменов типа IV (базальная мембрана) коллагена. Эти антитела откладываются в базальных мембранах почки [в базальной мембране клубочков (БМК) и/или в базальной мембране почечных канальцев (БМПК)], а иногда и других органов (в базальной мембране альвеол, в базальной мембране сосудистой оболочки глаза). Поскольку такой эпитоп является частью повторяющейся субъединицы, равномерно распределенной в базальной мембране, то отложения IgG при исследовании с помощью иммунофлюоресцентной микроскопии будут выглядеть линейными (рис. 222-1, а). Обладающие большой плотностью электронов структуры комплексов антиген — антитело обнаруживаются при электронной микроскопии. Локальное взаимодействие аутоантитела с фиксированным и природным антигеном базальной мембраны ведет к локальной активации медиаторных систем, как это описано выше.
Хотя активация системы комплемента и способствует повреждению вследствие своего хемотаксического и цитолитического воздействия, повреждение клубочков может происходить и независимо от активации комплемента. Протеину-рия развивается в результате утраты клубочковых анионных радикалов (гл. 40), а также структурных повреждений стенки капилляров. Скорость клубочковой фильтрации может снизиться, если утраченная величина площади фильтрующей поверхности перевесит величины адаптационных повышений капиллярного кровотока и давления в сохранившихся участках нефрона. Утечка макромолекул и клеток, таких как фибриноген и моноциты, в капсулу почечного клубочка через разрывы в стенке капилляров может спровоцировать экстракапиллярную пролиферацию (серповидные отложения), поскольку фибриноген полимеризован в фибрин, а моноциты делятся, пролиферируют и локально высвобождают монокины.
Заболевание почек, обусловленное образованием аутоантител против антигенов базальной мембраны, наблюдается главным образом при трех состояниях: при сочетании гломерулонефрита и легочного кровотечения, вызванном анти-БМК-антителами (синдром Гудпасчера); при идиопатическом серповидном гломерулонефрите, вызванном действием анти-БМК-антител (без легочного кровотечения) и при идиопатическом тубулоинтерстициальном нефрите, обусловленном образованием анти-БМПК-антител. При всех этих состояниях существуют характерные отличительные признаки, позволяющие выявить патогенетические механизмы основного заболевания: 1) имеются циркулирующие в крови антитела, реагирующие in vitro с антигенами базальной мембраны; 2) в пораженной ткани присутствуют линейные отложения IgG; 3) элюаты из пораженной ткани будут содержать IgG, реагирующий с нормальными, природными антигенами базальной мембраны как in vivo, так и in vitro.
Другие заболевания, вызванные антитканевыми антителами, не относящимися к клубочковой базальной мембране. В настоящее время становится очевидным, что стенка капилляров клубочков и мезангий состоят из ряда потенциально иммуногенных гликопротеидов, отличающихся от классического гликопротеида БМК, о котором речь шла ранее. Формы распределения этих антигенов на стенке капилляра клубочка и/или в мезангий различны, и они, вероятно, представляют собой биохимически особые структурные компоненты клубочка. Поэтому связывание с этими антигенами in situ пассивно введенных гетерологичных антител или активно индуцированных антител приведет к образованию иных картин локализации иммуноглобулина, так же как и функциональных, и структурных изменений стенки капилляра. Если такой антиген будет локализован в виде гроздьев по отношению к стенке капилляра, то его реакция с антителом in situ может вызвать образование прерывистых отложений Ig, выявляемых при помощи иммунофлюоресценции, и электронно-плотных отложений, отмечающихся при электронно-микроскопическом исследовании. В то время как количество возможных взаимодействий антиген — антитело такой категории достаточно велико, лишь очень незначительное их число можно рассматривать в качестве причины, вызвавшей развитие заболевания клубочков или тубулоинтерстициальных поражений у человека. До настоящего времени эксперименты на животных проводятся более ускоренным темпом, чем возрастает понимание аналогов этих механизмов у человека. Наиболее детально исследован на животной модели нефрит Хеймана, который индуцируют у крыс пассивным введением гетерологичных антител к определенному антигену стенки капилляров клубочков или посредством активной иммунизации этим антигеном с помощью адъюванта Фрейнда. Взаимодействие антиген — антитело происходит в субэпителиальном слое клубочка и на щеточной каемке клеток проксимального участка канальца, где этот антиген синтезируется в виде компонента покрытых клатрином ямок на поверхности эпителиальных клеток клубочков и проксимального участка канальца. Зернистые отложения IgG и плотные субэпителиальные отложения обнаруживаются соответственно с помощью иммунофлюоресценции и электронной микроскопии. Сходный с описанным выше механизм, возможно, лежит в основе развития некоторых случаев идиопатического мембранозного гломерулонефрита у человека.
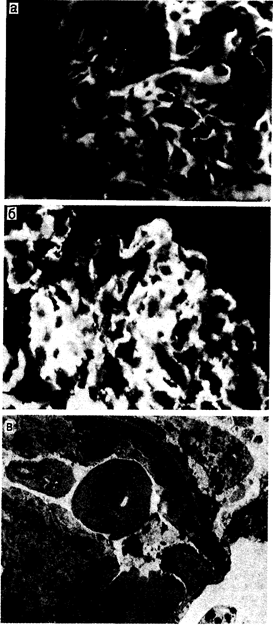
Рис. 222-1. Микрофотографии части клубочка почки больного с повреждением клубочков. а — иммунофлюоресцентная микрофотография части клубочка почки больного с повреждением клубочков, вызванным антителами к антигенам клубочковой базальной мембраны [обратите внимание на линейные отложения (меченный флюоресцеином античеловеческий IgG)]; б — иммунофлюоресцентная микрофотография части клубочка почки больного с повреждением клубочков, вызванным иммунными комплексами [обратите внимание на нерегулярные зернистые отложения (меченный флюоресцеином античеловеческий IgG)]; в — электронная микрофотография части клубочкового капилляра почки больного с повреждением клубочков, вызванным иммунными комплексами [обратите внимание на электронно-плотные отложения (0)].
И наконец, в настоящее время твердо установлено, что как циркулирующие в крови эндогенные вещества, так и вещества, содержащиеся в окружающей среде, обладающие специфическим биологическим или биохимическим сродством к структурам клубочков, включая стенку клубочковых капилляров и мезангий, могут откладываться в этих структурах неиммунным путем и, таким образом, действовать как «внедренный» антиген. Выработка антител, или реакция клеток на эти внедренные неклубочковые антигены, может привести к развитию заболевания в результате образования комплексов антиген — антитело in situ. Вид поражения будет определяться локализацией отложений внедрившегося антигена и характером иммунного ответа. Примерами таких внедренных антигенов, описанных до настоящего времени, являются некоторые лекарственные средства, пектины растений, канонизированные белки плазмы, агрегированные иммуноглобулины и дезоксирибонуклеиновая кислота. Было описано несколько экспериментальных моделей такой патогенетической последовательности, но информации относительно степени распространенности этого механизма при заболеваниях почек у человека недостаточно.
Поражение почек, вызванное иммунными комплексами (гл. 261). Болезнь циркулирующих иммунных комплексов. Отложение в почках образовавшихся в циркулирующей крови иммунных комплексов служит причиной развития большинства тех заболеваний почек, при которых ясно прослеживается участие в них какого-либо иммунного процесса. При заболеваниях этой категории в кровь из эндогенного или экзогенного (окружающая среда) источника проникает иммуногенное воспроизводимое или не воспроизводимое вещество. Реакция выработки антител к этому антигену, развивающаяся в то время как последний остается в системе кровообращения, приводит к образованию агрегата антигена и антитела, известного под названием циркулирующего иммунного комплекса. Если какая-либо небольшая часть циркулирующих иммунных комплексов не будет выведена из крови мононуклеарной фагоцитарной системой, она будет поглощена сосудистыми структурами, включая клубочки почек. Удержанные этими структурами циркулирующие иммунные комплексы могут вызывать воспаления при помощи многих медиаторных систем, описанных выше. Примером одной из наиболее изученных разновидностей такой болезни циркулирующих иммунных комплексов, в происхождении которой принимает участие невоспроизводимый антиген, является сывороточная болезнь, развивающаяся в результате острого или хронического введения иммуногенного, растворимого, гетерологичного белка инородной сыворотки. Небольшая часть этих иммунных комплексов будет затем локализоваться в мезангий клубочков, в стенках периферических капилляров, а также в суставах, клапанах сердца, сосудистом сплетении глаза, синусах селезенки и в крупных кровеносных сосудах, особенно в тех местах, где кровоток приобретает турбулентный характер. Депонированные иммунные комплексы вызывают развитие воспалительной реакции в местах своего отложения.
Хотя в приведенном выше схематическом изображении процесса заранее предполагается, что иммунные комплексы образуются в системе кровообращения, а затем откладываются в сосудистых структурах, можно также предположить, что они образуются также и во внесосудистом (интерстициальном) пространстве в результате диффузии клеточных антигенов и циркулирующих в крови антител. Этим феноменом можно объяснить отложение иммунных комплексов в интерстиции почек при относительной сохранности клубочкового кровообращения. Независимо от характера происхождения того или иного антигена или антитела или от конкретных условий, в которых происходят соответствующие иммунные процессы, ценную информацию, подтверждающую наличие отложений иммунных комплексов, дает морфологическая картина, обнаруживаемая при исследовании тканей при помощи иммунофлюоресценции или электронной микроскопии. Зернистые, прерывистые или неравномерные отложения IgG, часто в сочетании с компонентами системы комплемента, выявляются при иммунофлюоресцентном исследовании (рис. 222-1,б), в то время как электронно-плотные отложения наблюдаются при электронной микроскопии (рис. 222-1, в). Иногда эти отложения приобретают определенную субструктуру, но в большинстве случаев имеют гомогенный характер. Эти отложения могут локализоваться в нескольких участках внутри клубочка: под эпителиальными клетками (субэпителиально), внутри базальной мембраны (внутримембранно), под эндотелием (субэндотелиально) и в матриксе мезангия. Иногда иммунные комплексы локализуются в сети пери-канальцевых капилляров. Точная причина подобной локализации отложений еще недостаточно ясна, но нельзя исключить роль таких факторов, как размер или заряд конкретных комплексов, наличие внутри клубочковых структур рецепторов для Fc или компонентов комплемента или локальные изменения гемодинамики. Размер этих отложений, по-видимому, увеличивается за счет агрегации, и существуют некоторые данные о том, что клетки клубочков могут участвовать в их удалении. Стойкое присутствие отложений зависит от баланса скорости их образования и уравновешивающей ее активности систем их удаления. Сам IgG, содержащийся в циркулирующем в крови иммунном комплексе, отложившемся затем в клубочковых сосудах, может вести себя как внедренный антиген, или посредством идиотипических детерминант, имеющихся в местах связывания антигена на поверхности антитела, или через Fc-отделы, вызывающие антииммуноглобулиновую реакцию (ревматоидный фактор). Роли, которые соответственно играют антиидиотипическое антитело или ревматоидный фактор в эволюции повреждений клубочков при заболевании, вызванном иммунными комплексами, еще до конца не выяснены. После того как циркулирующие в крови иммунные комплексы отложились в клубочках, они вызывают местное воспаление и функциональные изменения, которые, по меньшей мере в отношении клубочкового кровообращения, относительно независимы от действия комплемента или полиморфно-ядерных лейкоцитов. Инфильтрирующие лейкоциты могут играть основную роль в опосредованном повреждении клубочков. Степень морфологических повреждений, возникающих в результате отложения иммунных комплексов, может сильно варьировать — от диффузных пролиферативных до непролиферативных мембранозных или склерозирующих повреждений. В определении вида морфологической реакции могут участвовать такие факторы, как свертывание крови, агрегация тромбоцитов, активация системы комплемента и высвобождение вазоактивных аминов.
Экзогенные антигены, участвующие в развитии болезни, вызванной циркулирующими иммунными комплексами, ведут свое происхождение главным образом от инфекционных агентов, таких как бактерии, вирусы или паразиты. Репликация какого-либо из этих микроорганизмов обеспечивает непрерывное поступление антигенов в организм. Примерами наиболее изученных состояний подобного рода у человека являются инфекционный эндокардит, проказа, сифилис, гепатит В и малярия. Эндогенные антигены, участвующие в развитии заболеваний у человека, очень разнообразны; к их числу относятся ДНК, тиреоглобулин, аутологичные иммуноглобулины, строма эритроцитов, антигены почечных канальцев и опухолеспецифичные или связанные с опухолями антигены.
Повреждение клубочков, связанное с системой комплемента. Хотя данные относительно того, может ли активация комплемента независимо от антиклеточных антител или от отложений циркулирующих в крови иммунных комплексов вызвать повреждение клубочков, немногочисленны, определенная связь между комплементом и заболеванием почек у человека существует. Клинико-патологическое состояние, известное под названием идиопатического мезангиокапиллярного гломерулонефрита (см. также гл. 223) может быть связано с отложением компонентов сывороточного комплемента внутри клубочков, позволяя предположить вовлечение альтернативного пути активации комплемента, возможно, не связанного с отложением иммунных комплексов. Однако такая разновидность отложения не обязательно свойственна исключительно этой группе нарушений, поскольку их можно также наблюдать при большом числе разных постинфекционных гломерулонефритоподобных осложнений и при некоторых коллагено-сосудистых заболеваниях.
Как уже было рассмотрено детально в гл. 62, альтернативный механизм активации комплемента зависит от взаимодействия агрегированного или иммунокомплексного IgA, полисахаридов или липополисахаридов с факторами В и D альтернативной системы комплемента и фактором С3 классической системы комплемента. Затем образуется способный расщеплять натуральный С3 фермент, состоящий из фрагмента С3 (С3b) и измененной формы фактора В (Вb). Эта С3-конвертаза альтернативного пути активации комплемента подобна С3-конвертазе, образующейся при осуществлении классического пути активации комплемента. Конвертаза С3 альтернативного пути стабилизируется посредством связывания с пропердином и разрушается несколькими инактиваторами (С3b-инактиватор, 1Н). Конвертаза С3 альтернативного пути расщепляет С3 на С3а (анафилатоксин 1) и С3b, который в дальнейшем расщепляется под действием инактиватора С3 на С3с и C3d, являющиеся биологически неактивными фрагментами. Фрагмент С3b, образованный таким образом, также может аутокаталитически образовывать дополнительную конвертазу С3 альтернативного пути в присутствии факторов В, D и Mg2+. Отличительными признаками альтернативного пути активации комплемента являются сниженные уровни содержания естественного С3 в сыворотке крови, циркулирующие в крови фрагменты С3 (С3с, C3d), низкая концентрация фактора В и циркулирующие в крови фрагменты В (Вb), причем все эти изменения происходят на фоне отсутствия изменений концентраций ранних компонентов классической системы комплемента C1q, C4 и С2. Терминальные компоненты комплемента от С5 до С9 также могут быть активированы и даже привести к лизису клеток в отсутствие антител. Угнетение синтеза С3 также может вносить свой вклад в снижение его концентраций в сыворотке крови, поскольку циркулирующие в крови фрагменты С3 могут снижать продуцирование клеток.
При идиопатическом мезангиокапиллярном гломерулонефрите, особенно его подвиде, известном под названием болезни плотных отложений, уровни содержания С3 в сыворотке крови снижены; концентрации C4, С1 и С2 близки к их нормальным значениям, а фрагменты С3 могут оказаться депонированными в клубочках без Ig (см. также гл. 223). Кроме того, в крови часто обнаруживают олигоклональные антитела (иммуноконглютинин) к конвертазе С3 альтернативного пути активации. Эти аутоантитела реагируют с соответствующим неоантигеном конвертазы С3 альтернативного пути. и оказывают действие, подобное действию пропердина, предохра-няя»этот фермент от воздействия на него инактиватора С3b и 1Н. В результате содержащие эти аутоантитела сыворотки оказываются способными индуцировать расщепление С3 in vitro, позволяя создавать стабильную жидкую фазу конвертазы С3. Это антитело известно также под названием С3 нефритогенного фактора (С3НФ); оно было впервые обнаружено в сыворотках крови больных с гломерулонефритом, характеризующимся стойким снижением уровней содержания С3.
Взаимосвязь этих аберраций пути активации комплемента с повреждением. клубочков неясна. Ни одна из существующих экспериментальных моделей стойкой активации альтернативного пути не вызывала развития гломерулонефрита; таким образом, повреждение клубочков в этих случаях может быть близко связанным, но независимым в патогенетическом отношении феноменом, возможно, генетически детерминированным. Осознание того факта, что определенные структурные гены компонентов комплемента (С2, C4) тесно связаны с главным комплексом гистосовместимости (ГКГС), дает возможное объяснение взаимосвязи предрасположенности к данному заболеванию и дефектами в биосинтезе белков комплемента. С другой стороны, некоторые исследователи предполагают, что стойкая гипокомплементемия может препятствовать нормальному процессу удаления таких антигенов окружающей среды, как вирусы. Этот дефект может обусловить стойкое присутствие этих антигенов в системе кровообращения и повысить вероятность образования циркулирующих в крови иммунных комплексов. Обнаружение того факта, что С3 и продукты его деградации (главным образом С3b) способны переводить в растворимую форму агрегаты антигенов и антител, может дать еще одно возможное объяснение связи возникновения болезни иммунных комплексов с дефектами синтеза комплемента или его активации.
Роль клеточного иммунитета в развитии поражений клубочков и тубулоинтерстициальных заболеваний. Роль каждого из таких факторов, как специфически сенсибилизированные клетки, действующие независимо от антитела (цитотоксические Т-клетки), «вооруженные» макрофаги и антителозависимая опосредуемая клетками цитотоксичность, в патогенезе поражений клубочков и тубулоинтерстициальных заболеваний трудно установить точно. Клубочки и, более чем вероятно, интерстиций коры почек обладают всеми элементами, необходимыми для поддержания опосредуемого клетками иммунного ответа на действие аутологичных или гетерологичных антигенов. Мононуклеарные клетки, способные к процессированию антигена и активации индукторных Т-клеток-хелперов только в главном комплексе гистосовместимости, присутствуют в мезангии клубочков и в интерстиций. Был разработан ряд экспериментальных заболеваний почек, большинство из которых представляли собой тубулоинтерстициальные нефриты, которые являлись следствием только клеточного иммунного ответа. Однако в настоящее время сравнительно небольшое число заболеваний у человека можно с полной уверенностью отнести за счет исключительно опосредуемых через клетки иммунных процессов. Примером этого служит отторжение почечных аллотрансплантатов у несенсибилизированных реципиентов. Эта проблема детально рассмотрена в гл. 221.
С помощью ряда различных методик in vitro можно продемонстрировать опосредуемую клетками гиперчувствительность как к экзогенным (из окружающей среды), так и к эндогенным антигенам при некоторых заболеваниях почек, включая гломерулонефрит. Точная роль, которую играют такие «сенсибилизированные» клетки в фактическом повреждении тканей, неясна, особенно при поражении клубочков у человека. Без сомнения, дальнейшее углубление знаний в области межклеточных взаимодействий в конечном итоге прояснит эту неопределенность. Весьма вероятно, что в отношении некоторых болезней, которые не попадают в категорию опосредуемых антителами или иммунными комплексами, будет установлено, что их развитие объясняется клеточно-опосредуемыми реакциями. Вероятно, что в эту категорию заболеваний можно включить так называемую болезнь минимальных изменений, представляющую собой один из морфологических подвидов идиопатического нефротического синдрома. Кроме того, из-за выраженной инфильтрации лимфоидными клетками, наблюдаемой при различных видах хронического тубулоинтерстициального нефрита, было высказано предположение, что эти заболевания почек тоже являются примерами клеточно-опосредуемых реакций (см. гл. 226).
Дата добавления: 2015-07-22; просмотров: 970;
