Гематологические и иммунологические нарушения 2 страница
Лечение при почечной недостаточности следует начинать в такой период течения болезни, когда осложнения ее будут умеренными, а не тогда, когда болезнь протекает бессимптомно. Раннее начало лечения позволит избежать тяжелых осложнений уремии (гл. 220). Раннее начало диализа особенно целесообразно при лечении тех больных с острой почечной недостаточностью, у которых можно ожидать восстановления функции почек, а также больных с хронической почечной недостаточностью, у которых имеет место хорошая иммунологическая совместимость с родственником-донором, а своевременно выполненная операция трансплантации почки, по всей вероятности, приведет к восстановлению нормальной функции органа. Что касается остальных больных, то клиническое суждение о целесообразности перехода от консервативного лечения к диализу или трансплантации должно быть основано на ознакомлении с анамнезом и взвешенном рассмотрении соотношения благоприятных последствий для больного в результате применения каждого метода лечения и связанного с таким лечением риска. Лечение с помощью ограничения количества поступающего в организм белка, как это показано в гл. 220, может продлить время нахождения больного на консервативном лечении, прежде чем возникнет необходимость в проведении диализа и трансплантации; но такое лечение следует проводить только в том случае, если связанные с ним осложнения не окажут отрицательного влияния на отдаленный прогноз болезни.
Вопрос, касающийся отбора больных для проведения диализа и/или трансплантации, вызывает некоторые разногласия. Ввиду обратимого характера острой почечной недостаточности все больные, которым поставлен такой диагноз, должны получать поддерживающую терапию при помощи диализа по меньшей мере в в течение определенного промежутка времени, чтобы дать возможность почкам восстановить нормальную функцию. Что касается больных с необратимой, или хронической, почечной недостаточностью, то критерии их отбора для проведения трансплантации обычно более строгие, чем для проведения диализа, и руководствоваться при этом следует учетом возможности развития осложнений, связанных с проведением иммуносупрессивной терапии. В табл. 221-1 приведены некоторые практические соображения относительно выбора реципиента для получения аллоренотрансплантата. Такую процедуру следует предпринимать только в том случае, если консервативная терапия не дала ожидаемого результата, когда отсутствуют обратимые элементы в почечной недостаточности у данного больного, и тяжесть заболевания такова, что обычные методы лечения не могут обеспечить ему комфортабельное существование. Однако прогноз будет более благоприятный в том случае, если трансплантация выполнена до того, как состояние больного перейдет в критическую стадию. Трансплантацию не следует использовать в качестве средства спасения больных от неосуществления надежды на успех при проведении диализа.
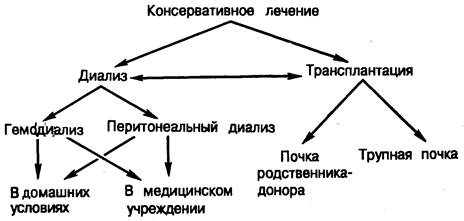
Рис. 221-1. Альтернативные методы лечения больных с почечной недостаточностью.
У реципиента не должно быть угрожающих жизни внепочечных осложнений, таких как рак, тяжелая ишемическая болезнь сердца и заболевание сосудов головного мозга. Диабет как таковой не является противопоказанием для трансплантации при условии, что у больного нет диффузного поражения сосудов. Относительным противопоказанием для проведения трансплантации является оксалоз, так как в трансплантированной почке сравнительно быстро может наступить рецидив. Хотя возраст больного может служить ограничительным фактором, но противопоказанием для трансплантации является скорее соответствующий состоянию органов старого человека «физиологический», чем хронологический возраст. В общем больные достигают «физиологического» предела в хронологическом возрасте приблизительно 60—65 лет, когда частота осложнений, обусловленных действием преднизона, становится намного выше, чем у более молодых больных. Хотя заболевания мочевого пузыря и мочеиспускательного канала представляют собой дополнительную опасность, были осуществлены успешные трансплантации почечных аллотрансплантатов страдающим такими заболеваниями больным с предварительным формированием искусственного мочевого пузыря (например, из участка подвздошной кишки), в который вшивают мочеточник донорской почки. Очевидно, что трансплантацию не следует предлагать больным, страдающим каким-либо заболеванием, течение которого может обостриться под действием преднизона, циклоспорина, азатиоприна или других имммуносупрессивных средств, а также любому больному, страдающему столь тяжелыми осложнениями консервативного лечения, что они увеличивают риск выполнения операции и лекарственной терапии. При оценке заболеваний, потенциально исключающих возможность трансплантации, следует иметь в виду, что качество жизни и отдаленные результаты лучше всего обеспечиваются при успешной трансплантации почек.
Таблица 221-1. Противопоказания к трансплантации почек
1. Абсолютные противопоказания: а) обратимое поражение почек б) возможность поддержания полноценной жизни с помощью консервативного лечения в) тяжелые формы основных внепочечных осложнений (поражение венечных сосудов и сосудов головного мозга, опухоли) г) активная инфекция д) активный гломерулонефрит е) предшествующая сенсибилизация к ткани донора
2. Относительные противопоказания (см. текст): а) возраст б) заболевание мочевого пузыря или мочеиспускательного канала в) окклюзивное поражение подвздошных и бедренных артерий г) сахарный диабет д) психические болезни е) оксалоз
Критерии отбора больных для проведения лечения с помощью гемодиализа или перитонеального диализа менее строгие, чем для трансплантации, поскольку диализ связан с меньшим риском, чем трансплантация, у пожилых больных и у больных, страдающих упомянутыми выше осложнениями консервативного лечения. В связи с высокой стоимостью этих программ слышались предложения ограничить число больных, назначаемых на проведение диализа и трансплантации. Такого рода решения, базирующиеся на моральных и социальных соображениях, продолжают вызывать споры. В большинстве регионов мира в настоящее время оплату стоимости медицинского обслуживания больных с хронической почечной недостаточностью берет на себя государство. При экономической поддержке государством программ проведения диализа и трансплантации разработаны и будут разрабатываться в дальнейшем соответствующие правила и инструкции, позволяющие совершенствовать отбор больных для лечения различными методами.
Консервативное лечение. Как было показано в гл. 220, консервативное (не диализ и не трансплантация), лечение следует начинать на ранней стадии заболевания, для того чтобы иметь возможность контролировать симптомы заболевания, свести к минимуму возможные осложнения, предотвратить отдаленные последствия уремии и замедлить прогрессирование почечной недостаточности. Следует предпринять все необходимые меры для корррекции любого из многочисленных обратимых компонентов заболевания, которые отягчают поражение почек. У больных с острой почечной недостаточностью следует выявить и скорригировать преренальные факторы, такие как снижение объема жидкости в организме и минутного объема сердца, или стеноз почечных артерий, а также постренальные факторы, такие как окклюзия мочеточника или мочеиспускательного канала. Такие пре- и постренальные факторы могут обострить основное заболевание паренхимы почек и у больных с хронической почечной недостаточностью, поэтому на них также следует обратить внимание у больных этой группы. Самым важным является лечение основного заболевания или осложнений почечной недостаточности, которые еще более ускоряют процесс потери нефронов. Следует проводить агрессивное лечение гипертензии, инфекционных заболеваний мочевых путей, почечнокаменной болезни, структурных нарушений мочевых путей или тех форм гломерулонефрита, которые поддаются лечению. К числу профилактических мер относятся отказ от употребления нефротоксических лекарственных средств и больших доз рентгеноконтрастных средств при лечении больного, у которого уже имел место риск развития почечной недостаточности.
Изменение пищевого рациона— важный аспект консервативной терапии. Ограничение в ранние сроки развития болезни поступающих в организм количеств натрия и жидкости может иметь большое значение для профилактики гипертензии. По мере прогрессирования почечной недостаточности необходимо ограничивать количество потребляемых пищевых продуктов с высоким содержанием фосфора и калия. Снижение потребления продуктов, содержащих белок, смягчает выраженность анорексии, тошноты и рвоты, а если начать ограничения потребления таких продуктов в ранние сроки, это может замедлить прогрессирование заболевания. Взрослые больные должны получать не менее 0,6 г белка на 1 кг массы тела в сутки для предотвращения развития отрицательного азотистого баланса. Дополнение низкобелкового пищевого рациона введением незаменимых кетоаминокислот может оказаться полезным в целях удлинения срока проведения консервативного лечения, позволяя утилизировать мочевину в качестве источника заменимого азота. В более поздних стадиях развития уремии необходима коррекция нарушений электролитного баланса, например применение бикарбоната натрия или карбоната кальция для коррекции слабого ацидоза, или же использование бикарбоната, D-глюкозы и инсулина, а также калийобменных смол для лечение гиперкалиемии. Некоторые химические аномалии, имеющие место при нарушении функции почек, не требуют лечения или же не поддаются лечению; гипермагниемия, гиперамилаземия, гипертриглицеридемия или слабая степень нарушения толерантности к углеродам обычно не требуют лечения. Лечение гиперурикемии назначают в том случае, если больной страдает подагрой. Однако не было установлено, чтобы урикемия сама по себе оказывала какое-либо пагубное воздействие. Было высказано предположение о том, что вторичный гиперпаратиреоз может стимулировать прогрессирование почечной недостаточности. Неясно, обусловлено ли это гиперфосфатемией, повышенным значением произведения кальций фосфор или действием самого паратгормона. Тем не менее энергичные усилия по использованию фосфорсвязывающих веществ и дополнительное введение кальция и аналогов витамина D (дигидротахистерола или 1,25-дигидроксихолекальциферола) для поддержания соответствующей концентрации кальция в сыворотке крови эффективно подавляет осуществляемую паращитовидными железами стимуляцию, возможно, замедляют прогрессирование почечной недостаточности и, по всей вероятности, предотвращают последующее тяжелое поражение костей (гл. 336). Для того чтобы предотвратить кальцификацию внутренних органов и сосудов, важно поддерживать величину произведения фосфор • кальций на уровне ниже 60. Необходимость ограничивать поступление в организм жидкости, натрия, калия, фосфора и белка часто приводит к чрезмерному ограничению пищевого рациона, что делает его неприемлемым для больного. Это обстоятельство, а также проблема введения в организм множества различных лекарственных средств часто встают на повестку дня в то время, когда появляются осложнения уремии, и поднимают вопрос о выполнении диализа и/или трансплантации.
Наряду с проведением мероприятий консервативного лечения необходимо вести подготовку больного с помощью интенсивной просветительской программы в целях разъяснения ему возможных конечных результатов почечной недостаточности и сущности различных доступных в настоящее время видов терапии. Чем более адекватными знаниями относительно гемодиализа, перитонеального диализа и трансплантации будут обладать больные, тем легче им будет принять впоследствии правильное решение. При проведении гемодиализа основным способом получения крови для лечения является использование артериовенозного шунта. Поскольку для его формирования часто требуется несколько месяцев, профилактическое формирование такого шунта у больного, которому в будущем планируется проведение гемодиализа, имеет большое значение для уменьшения риска развития в будущем осложнений, связанных с доступом циркулирующего диализата. Что касается больных, выбравших перитонеальный диализ (постоянный амбулаторный перитонеальный диализ — ПАПД или постоянный циклический перитонеальный диализ—ПЦПД), то у них введение перитонеального катетера не требует предварительной подготовки и лечение может быть начато сразу после развития симптомов и признаков уремии. Что же касается больных, которым могут назначить проведение диализа в домашних условиях или трансплантацию, то предварительно следует провести просветительскую работу среди членов их семей для последующих отбора и подготовки из их числа лиц, которые будут помогать проведению диализа или из числа которых будет выбран донор почки; и такую подготовку следует начинать задолго до развития симптомов почечной недостаточности. В отношении больных, у которых имеет место хорошая антигенная совместимость с желающим отдать свою почку донором, целесообразно рассмотреть возможность выполнения трансплантации без предварительного проведения гемодиализа или перитонеального диализа. При рассмотрении вопроса о трансплантации почки от донора-родственника следует принять во внимание риск, связанный с проведением односторонней нефрэктомии, включая развитие протеинурии и гипертензии. Как будет видно из приведенного ниже, частота случаев успешной трансплантации трупной почки значительно возросла, и поэтому эту возможность следует тщательно обсудить с самим больным и с членами его семьи, являющимися потенциальными донорами.
Гемодиализ. В основе гемодиализа лежит принцип диффузии веществ через полупроницаемую мембрану (целлофан, ацетатцеллюлоза, полиакрилонитрил и полиметилметакрилат) с целью выведения из крови нежелательных веществ и одновременного введения в нее необходимых компонентов. Постоянный ток крови по одну сторону мембраны и очищающего раствора-диализата — по другую ее сторону позволяет удалить остаточные продукты обмена веществ из крови спо собом, весьма сходным с процессом клубочковой фильтрации. Изменяя состав диализата, способ взаимодействия крови и диализата (геометрию диализатора), тип и площадь поверхности диализирующей мембраны и частоту и продолжительность сеансов диализа, можно поддерживать в относительно благополучном состоянии даже тех больных, у которых почки совсем не функционируют. Оборудование для проведения гемодиализа состоит из трех основных частей — системы подачи крови; системы, обеспечивающей необходимый состав и подачу диализата, и самого аппарата-диализатора. Кровь подается под давлением в диализатор с помощью роликового насоса через систему трубок, оснащенных соответствующими приборами для измерения величины скорости кровотока и давления в системе; величина скорости кровотока должна составлять приблизительно 250— 300 мл/мин. Величину гидростатического давления в системе можно изменять соответствующим образом для достижения желаемой степени выведения жидкости, так называемой ультрафильтрации. Диализат подается в диализатор из емкости, в которой он хранится, или из дозирующей системы, в которой он вырабатывается. В большинстве диализаторов диализат проходит через мембрану один раз, двигаясь навстречу току крови со скоростью 500 мл/мин, или же рециркулирует много раз, но соответственно с более высокой скоростью тока. Состав диализата сходен с составом плазменной жидкости, но его можно изменять в зависимости от потребностей конкретного больного. Существуют два основных типа диализаторов — плоскопластинчатый диализатор, в котором плоские листы мембраны уложены один на другой, с проложенными между ними пластиковыми матрицами; и пустотеловолоконный, или капиллярный, диализатор, в котором мембранный материал закручен в спираль внутри тонких капилляров, тысячи которых собраны, в пучки; кровь течет через эти капилляры, в то время как диализат циркулирует с наружной стороны пучков волокон (рис. 221-2).
Большинство больных нуждаются в 10—15 ч диализа в неделю, разделенных на несколько равных по времени сеансов. Конкретная для каждого больного продолжительность сеансов зависит от размеров тела, остаточной функции почек, диеты, осложняющих заболеваний и степени анаболизма или катаболизма в организме больного. Продолжительность сеансов диализа, частота сеансов, тип и размер диализатора, состав диализата, скорости кровотока или тока диализата — все эти параметры можно изменять таким образом, чтобы они удовлетворяли специфические потребности конкретного больного. Разработанное в последние годы моделирование кинетики процесса диализа, использование данных о процессе образования мочевины и скорости катаболизма белка обеспечили возможность более обоснованного назначения длительности сеансов и других условий проведения диализа.
Многие осложнения, развивающиеся у находящихся на диализе больных, связаны с основными заболеваниями или с теми уремическими состояниями, которые не поддаются коррекции с помощью диализной терапии. Эти и другие сходные проблемы, возникающие при гемодиализе, рассмотрены в гл. 220. Ахиллесовой пятой гемодиализма является подключение диализатора к системе кровообращения больного. Разработанная в начале 60-х годов методика с использованием артериовенозного шунта сделала возможным проведение хронического диализа. Однако такой шунт часто подвергался инфицированию и тромбозу, и это побудило к созданию в 1966 г. артериовенозной фистулы. Фистулу предпочтительнее формировать из природной вены, но если по какой-либо причине это невозможно, то формируют подкожный протезный канал (из дакрона или из политетрафторэтилена, из сонных артерий быка, из пупочной артерии человека), соединяющий артерию и ближайшую вену. Канюляция артериовенозной фистулы иглами 15— 16-го калибров обеспечивает достаточный для осуществления гемодиализа кровоток. К сожалению, и в артериовенозной фистуле возможны инфицирование, тромбоз и образование аневризмы, особенно в искусственный протезах. Частота случаев развития септицемии и септической эмболизации, связанной с инфицированием шунта и фистулы, относительно высока; самым распространенным возбудителем инфекции служит золотистый стафилококк.
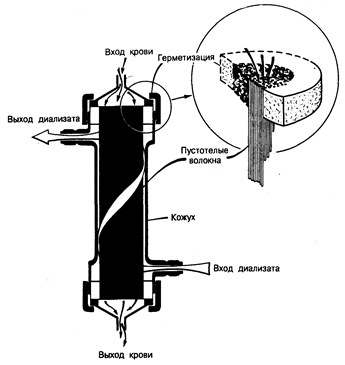
Рис. 221-2. Пустотеловолоконный, или капиллярный, диализатор, представляющий собой чаще всего используемый аппарат «искусственная почка».
Кроме того, неудачи в использовании артериовенозной фистулы оказывают серьезное психологическое воздействие на больного. В подобных случаях больные встречаются и с другими психиатрическими проблемами — депрессией и переоценкой представления о самом себе. Резкие изменения осмоляльности могут вызвать развитие у больного дисэквилибрационного синдрома, в то время как резкие изменения концентрации электролитов (особенно калия) — развитие аритмии во время сеанса диализа. Очень часто во время диализа развивается гипотензия; она обусловлена влиянием многих факторов — объемом экстракорпорального кровообращения, степенью ультрафильтрации, изменением осмоляльности сыворотки крови, наличием невропатии вегетативной нервной системы, сопутствующим применением гипотензивных средств, выведением катехоламинов или введением ацетата (используемого в качестве буферного средства в диализате), угнетающего сердечную деятельность и расширяющего сосуды. Могут развиться синдромы диализного слабоумия и остеомаляции в случае загрязнения диализата алюминием или перорального приема гидроокиси алюминия. Повышенная частота развития ГВ-П (гепатит В—поверхность) антигенемии обусловлена ослаблением иммунологической реакции. У страдающих хронической антигенемиеи больных обычно не наблюдают выраженных симптомов заболевания, а функция печени нарушена лишь незначительно. Отмечается более высокая частота развития ни А ни В гепатита и цитомегаловирусной инфекции, но обычно и эти заболевания протекают сравнительно легко. Механические и/или ятрогенные осложнения, такие как гемолиз, воздушная эмболия, кровопотеря и загрязнение диализата, стали менее распространенными в связи с совершенствованием оборудования. Могут развиваться неблагоприятные реакции, индуцированные артериовенозной фистулой, примером которых служат опосредуемая через комплемент лейкопения и гипоксемия, обусловленные взаимодействием крови с целлофаном. Более выраженные симптомы, такие как боли в груди и спине, бронхоспазм и анафилаксия, при таких реакциях развиваются редко. Гепарин, введение которого необходимо при проведении гемодиализа, может вызвать такие ослож нения, как субдуральная гематома и забрюшинное, желудочно-кишечное, перикардиальное и плевральное кровотечения. Одной из важнейших проблем, с которой в течение длительного времени сталкиваются при лечении гемодиализом, является высокая летальность больных в результате инфаркта миокарда и мозговых инсультов. Вероятно, это обусловлено наличием у больных с уремией существовавших ранее и продолжающих действовать распространенных факторов риска, таких как гипертензия, гиперлипидемия, кальцификация сосудов вследствие гиперпаратиреоза, большая величина минутного объема сердца вследствие анемии, или другими причинами. Потенциальная возможность развития этих осложнений должна побудить врача оценить соотношение риск/польза от проведения диализа, прежде чем приступить к его выполнению у каждого конкретного больного. Преимущества гемодиализа заключаются в сравнительной непродолжительности сеансов диализа и минимальном изменении сложившегося образа жизни в периоды между сеансами. Он более эффективен, чем перитонеальный диализ, позволяет достичь быстрых изменений патологических биохимических показателей сыворотки крови. В присутствии помощника больной может выполнить гемодиализ в домашних условиях. Гемодиализ — самая распространенная форма диализа.
Перитонеальный диализ. Перитонеальный диализ, как и гемодиализ, можно выполнять в различных условиях и с помощью разных методик. Больным с острой почечной недостаточностью перитонеальный диализ обычно выполняют посредством введения катетера типа стилета в брюшную полость и непрерывного промывания брюшной полости в течение 24—72 ч. До тех пор пока не будут получены желаемые биохимические показатели и/или достигнуто улучшение клинического состояния больного, можно производить обмен 1—2 л диализата через каждые 20—60 мин. Затем катетер удаляют из брюшной полости и наблюдаютза состоянием до тех пор, пока появившиеся симптомы или результаты лабораторных исследований не укажут на необходимость проведения следующего 1—3-суточного сеанса перитонеального диализа. Попытки проведения хронического перитонеального диализа предпринимались с конца 40-х годов, но были относительно безуспешными до тех пор, пока в 1968 г. не был создан постоянный перитонеальный катетер — катетер Тенкхоффа. Использование этого постоянно находящегося в брюшинной полости катетера и оборудования, обеспечивающего подачу диализата по замкнутому непрерывному циклу, привело к созданию методики лечения, при которой больные получают лечение 2—3 раза в неделю, а суммарное время лечения составляет 30—40 ч (интермиттирующий перитонеальный диализ—ИПД); при этом достигаются значения клиренса различных веществ и объема выводимой жидкости, аналогичные тем же показателям, которых достигают при гемодиализе. Выдвинутая в 1978 г. концепция постоянного промывания брюшинной полости посредством увеличения времени нахождения в ней диализата привела к разработке ПАПД, который отличается от интермиттирующего перитонеального диализа тем, что больным через входное отверстие катетера вливают диализат в брюшинную полость и герметически закрывают отверстие катетера. Больные находятся под амбулаторным наблюдением, и каждые 4—6 ч опорожняют брюшинную полость и заменяют диализат новой его порцией. При этом используются 2-литровые емкости с диализатом и устраняется необходимость в специальном оборудовании для проведения диализа. Для некоторых больных более приемлемой может оказаться модификация этого метода с использованием устройства, позволяющего осуществить циклическое влияние диализата, причем его замена осуществляется в ночные часы, а в течение дня он находится в брюшинной полости (ПЦПД).
Острый перитонеальный диализ длительностью от 24 ч до 72 ч с использованием стилет-катетера обычно проводят в условиях стационара. ИПД или ПЦПД можно проводить в медицинском учреждении или дома (обычно в ночные часы), в то время как ПАПД можно выполнять в любых условиях. Как и при гемодиализе, состав диализата можно изменять в зависимости от величин ультрафильтрации и клиренса, необходимых для конкретного больного. Основное различие в составах перитонеального диализата и диализата для гемодиализа состоит в использовании в первом большего количества D-глюкозы, применяемой в качестве осмотического вещества, обеспечивающего выведение жидкости. Преимуществами перитонеального диализа является то, что он позволяет избежать гепаринизации и хирургических вмешательств на сосудах, а также меньшая величина клиренса, что может оказаться благоприятным обстоятельством для некоторых больных с нестабильным состоянием сердечно-сосудистой системы. Этот вид диализа более пригоден для самостоятельного проведения. К числу недостатков перитонеального диализа относится более длительное время лечения — более длительные периоды интермиттирующего диализа или постоянное осуществление диализа. Перитонеальный диализ не следует применять больным, недьвно перенесшим операции в брюшной полости или лицам с заболеваниями легких. У некоторых больных при проведении перитонеального диализа может происходить неадекватный клиренс веществ, например у больных со склеродермией, васкулитами, злокачественной гипертензией или любым заболеванием, поражающим брюшину. К числу возможных осложнений относятся инфицирование тоннеля, в котором расположен катетер, перитонит, умеренная потеря белка, гипертриглицеридемия, гиперхолестеринемия, ожирение, а также паховая грыжа или грыжа живота. Для проведения ПАПД необходима высокая степень взаимопонимания между больным и врачом. Несмотря на то что при этом виде диализа чаще, чем при интермиттирующем перитонеальном диализе, развивается перитонит (главным образом из-за большого числа мест входа в систему), он является преобладающим видом перитонеального диализа.
Результаты. В конце 1983 г. на хроническом диализе находились приблизительно 72000 больных. В то же время за последние 15 лет в США около 55000 больных перенесли операции по трансплантации почек. Приблизительно 85— 90% больных находятся на гемодиа,лизе, в то время как 15% проводят перитонеальный диализ того или иного вида. Из всего числа новых больных с терминальной стадией почечной недостаточности приблизительно 35—50% из них (в соответствии с их физическим и психическим состоянием) может быть проведена трансплантация почки. Многие их этих больных сенсибилизированы, имеют высокий титр антител; они находятся на гемодиализе или перитонеальном диализе, ожидая подходящей трупной почки. По всей вероятности, больному с острым заболеванием или медицинскими осложнениями диализ будут проводить в диализном отделении больницы или в отделении интенсивной терапии, в то время как больные, состояние которых стабильно, могут получать сеансы диализа в амбулаторных условиях (в диализном отделении больницы или во внебольничном диализном медицинском учреждении) или в домашних условиях. В большинстве диализных центров больных пытаются привлечь к участию в уходе и лечении самих себя, т. е. к проведению так называемого самодиализа. В конце 1983 г. приблизительно 14 000 больных проводили в домашних условиях диализ; это составляет от 12 до 40% всех больных, находящихся на диализе (в зависимости от региона страны и таких факторов, как плотность населения, экономическое положение и уровень социального обеспечения в данном регионе). Многие больные предпочитают проводить диализ в домашних условиях (гемодиализ или перитонеальный диализ); они уверены в своих силах и не желают находиться в зависимости от больницы или диализного центра. Мотивация больного является основным фактором при решении вопроса о выборе места проведения самодиализа — дома или в диализном центре. Наиболее дорогостоящим является проведение диализа в условиях больницы, в то время как диализ, проводимый в домашних условиях с помощью кого-либо из членов семьи больного или самим больным без посторонней помощи (только перитонеальный диализ) обходится несколько дешевле, чем диализ, проводимый в диализном центре. Несмотря на то что для проведения перитонеального диализа необязательно иметь специальное оборудование, выполнение его в домашних условиях обходится не дешевле домашнего гемодиализа из-за стоимости диализата и оплаты последующего пребывания в больнице в связи с повышенной частотой случаев развития перитонита при его проведении.
Средний возраст находящихся на диализе больных не достигает 60 лет. Отчасти это объясняется тем, что у больных пожилого возраста велика вероятность нефросклероза и развивающейся в конечном итоге почечной недостаточности в результате других повреждающих паренхиму почек заболеваний. Не секрет и то, что в процессе отбора больных для проведения трансплантации предпочтение отдается лицам более молодого возраста.
Приблизительно у 10—20% больных с хронической почечной недостаточ ностью диализ обеспечивает полную реабилитацию, и еще у 30—40% не страдающих диабетом больных можно ожидать реабилитации до функционального состояния, даже если у них не восстановится работоспособность. Кроме того, у 20% больных будет достигнут такой уровень функционального состояния, который хотя и не считается реабилитационным, но вернет им способность обслуживать самих себя. Остальные больные (приблизительно 20%) будут полностью зависеть от помощи окружающих. Две последние группы в основном представлены больными диабетом, у которых показатели реабилитации и выживаемости значительно ниже, чем у не страдающих диабетом больных. Показатели летальности варьируют в зависимости от возраста больных и стадии заболевания, однако в большинстве программ хронического диализа годовые показатели летальности составляют приблизительно 5—10%.
Дата добавления: 2015-07-22; просмотров: 863;
