Гематологические и иммунологические нарушения 3 страница
Трансплантация
Трансплантация взятой у человека почки стала оправданной процедурой лечения при хронической почечной недостаточности в ее поздних стадиях. Во всем мире выполнены десятки тысяч подобных операций, а в некоторых медицинских центрах ежегодно проводят от 50 до более 100 таких операций. При использовании в качестве иммуносупрессивных средств азатиоприна (имурана) и преднизона, результаты трансплантации почки, взятой у соответственно подобранного донора-родственника, более обнадеживающие, чем при трансплантации трупной почки, и успех соответственно составляет 75—90% по сравнению с 50—60% случаев приживления трансплантата. В тех случаях, когда в схему лечения дополнительно вводили антилимфоцитарные глобулины (АЛГ), результаты трансплантации трупной почки приближались к результатам трансплантации почки, взятой у донора-родственника, по меньшей мере в течение первых лет после трансплантации.. В самое последнее время применение нового эндекапептида грибкового происхождения циклоспорина позволило значительно улучшить результаты трансплантации трупной почки и довести выживаемость больных в течение первого года до 80% в тех случаях, когда он используется в сочетании с преднизоном, вместо азатиоприна и АЛГ. При всех видах терапии частота случаев отторжения трансплантата значительно снижается после истечения первого года после трансплантации, хотя иногда может развиться острый необратимый эпизод отторжения через много месяцев хорошего функционирования трансплантированной почки. Вероятность этого возрастает, если больной пренебрегает приемом иммуносупрессивных средств. В последние годы клинические результаты трансплантации почек, оцениваемые по показателям заболеваемости и летальности больных, значительно улучшились; в ряде медицинских центров летальность снизилась до величины менее 5%. Это отражает все возрастающую тенденцию со стороны трансплантационных бригад уменьшать долю иммуносупрессивных средств с тем, чтобы в случае тяжелой реакции отторжения потерять трансплантированную почку, а не самого больного. Получены явные доказательства благоприятного воздействия на результаты трансплантации процедуры переливаний крови потенциальным реципиентам в подготовительном периоде. Реципиенты, которым не проводили переливаний крови, подвергаются более высокому риску отторжения их трансплантатов, в то время как многократные переливания крови от случайных доноров или от специально подобранного донора значительно увеличивают шансы больного на успешное приживление трансплантата. Все чаще выполняются повторные и даже третьи трансплантации, а их суммарные результаты показывают, что частота случаев ожидаемого приживления трансплантата снижается только на 10—20% по сравнению с первой трансплантацией; иными словами, отторжение трансплантата не обязательно предопределяет плохой результат еще одной попытки трансплантации.
Выбор донора. Источниками получения донорских почек служат трупы или добровольцы-доноры, являющиеся кровными родственниками больного. Добровольцы-доноры должны быть физически здоровыми и иметь ту же группу крови системы АВО, что и реципиент, так как перекрестная несовместимость по основным изоантигенам группы крови (АВО) наносит ущерб приживаемости трансплантата. Однако можно трансплантировать почку от донора, обладающего группой крови О (I), реципиенту с группой крови А (II), В (III) или АВ (IV). Донорам-добровольцам необходимо выполнить селективную артериографию почек, чтобы убедиться в отсутствии у них добавочных или поврежденных почечных артерий, поскольку наличие сосудистых аномалий затрудняет проведение хирургических вмешательств, а время, на протяжении которого трансплантированная почка подвергается ишемическому воздействию, становится недопустимо длительным. При отборе трупной почки для последующей трансплантации необходимо исключить у трупа-донора наличие злокачественных опухолей для того, чтобы избежать передачи заболевания реципиенту.
Разрабатывается базирующаяся на долевом участии заинтересованных организаций координированная в региональном или национальном масштабе система компьютеризованной информации и материально-технического снабжения, обеспечивающая доставку трупных почек к соответствующим реципиентам. В настоящее время существует возможность изъять почки из трупа и поддерживать их жизнеспособность в течение 48 ч при помощи пульсирующей перфузии охлажденной жидкостью или путем простого промывания и охлаждения. Это обеспечивает необходимое время для проведения типирования, проб на перекрестную совместимость, транспортировки и решения проблем отбора.
Типирование для определения тканевой совместимости и клиническая имму-ногенетика. В течение долгого времени в качестве идеального критерия для отбора доноров почечных аллотрансплантатов была принята совместимость по HLA-антигенам — главному генному комплексу гистосовместимости (гл. 63). Было показано, что в хромосомах млекопитающих всех изученных видов имеется единственный участок, который кодирует сильные, или главные, трансплантационные антигены. У человека имеется аналогичный 6-й хромосомный участок, называемый HLA. Тем не менее и другие антигены, называемые минорными («второстепенными»), могут играть решающую роль, особенно антигены групп крови и эндотелиальный антиген, находящийся в моноцитах периферической крови, но не в лимфоцитах. Данные, указывающие на участок HLA, как на генный участок, кодирующий главные трансплантационные антигены, были получены в результате успешного приживления у реципиентов трансплантатов почек и костного мозга, взятых от доноров-родственников, причем особенно успешные результаты получались у пар донор — реципиент, представляющих собой сингенных сибсов. Тем не менее 10—15% почечных аллотрансплантатов, взятых от сингенных сибсов, часто отторгаются уже в первые недели после трансплантации. Весьма вероятно, хотя и не доказано, что подобные неудачи обусловлены предварительной сенсибилизацией к антигенам, не имеющим отношения к HLA. Антигены, не имеющие отношения к HLA, относительно слабые, и поэтому их можно подавить с помощью обычной иммуносупрессивной терапии. Однако если примирование уже произошло, то вторичные реакции будут намного более устойчивыми. На самом деле несовместимость по антигенам системы АВН представляет опасность вследствие наличия естественных анти-А и анти-В антител.
Доноры-родственники. На протяжении более двух десятилетий, когда азатиоприн был основным иммунодепрессивным лекарственным средством, полученные у живых доноров-родственников почки лучше всего приживались после трансплантации. Среди родственников в первом колене общий уровень ожидаемого успешного приживления трансплантата находился в прямой зависимости от результатов проб на совместимость по гаплотипам 2, 1 или не-HLA, определяемой при помощи серологического HLA-типирования и по наличию или отсутствию пролиферативной реакции при проведении реакции смешанной культуры лимфоцитов (СКЛ-реакции) (гл. 63). У HLA-несовместимых сибсов показатели приживляемости трансплантатов были ненамного выше, чем средние показатели, получаемые при трансплантации трупных почек (50—60% в течение 1 года), в то время как у полуидентичных по антигенам HLA (гаплоидентичный) пар эти показатели составляли 70—75%. Было установлено, что результаты СКЛ-реакции среди гаплоидентичных родственников являются показателем реактивности. У пар донор—реципиент, обладающих низким уровнем реактивности, частота приживления трансплантата в течение 1 года составляла 90%, в то время как у пар с высоким уровнем реактивности этот показатель составлял 55% (в том случае, если не проводились переливания крови от специально подобранного донора для устранения этого недостатка). СКЛ-реакция представляет собой сравнительно неточный метод, но было неоднократно показано, что как в случае почек, взятых от живых доноров-родственников, так и в случае трупных почек, реактивность СКЛ-реакции со специфическим донором дает более точный прогноз приживляемости трансплантата, чем серологическое типирование по HLA-A, -В, -С или DR-антигенам. Результаты применения циклоспорина наносят сильный удар по предположению о том, что почки, взятые от живых доноров-родственников, имеют преимущество перед трупными почками, поскольку в большинстве выполненных в последнее время серий трансплантаций уровень успешного приживления трупных почек составил 80% от уровня успешного приживления в течение 1 года, ранее достигавшегося только при трансплантации почек, полученных от гаплоидентичных родственников. В настоящее время выбор типа донорской почки должен базироваться на таких факторах, как доступность органов и время ожидания находящегося на диализе больного, а не на ранее существовавшем представлении о частоте успешного приживления трансплантатов. Необходимо подчеркнуть, что различия в показателях долгосрочной приживляемости трансплантатов с учетом различных типов доноров и схем лечения еще предстоит уточнять. В случае применения азатиоприна период полужизни функционирующего трансплантата после первого года составляет 34 года при пересадке почек от HLA-идентичных доноров, 11 лет и 6 мес — при пересадке почек от гаплоидентичных доноров и 7 лет при пересадке трупных почек. Вопрос о том, может ли длительное применение циклоспорина, даже исходя из предположения, что не возникнет проблемы с его кумулятивным нефротоксическим действием, обеспечить более высокие показатели приживляемости трансплантата, в настоящее время остается открытым.
Трупные почки. При проведении первых трансплантаций с использованием циклоспорина суммарная частота успешного приживления трупных почек в течение 1 года составила 80%. Было чрезвычайно трудно оценить роль совместимости по HLA-антигенам при пересадке трупных почек из-за значительной вариабельности результатов, получаемых в разных медицинских центрах. Так называемая совместимость типа «полный дом» по двум HLA-A и двум HLA-B-антигенам между двумя не состоящими в родстве лицами не обеспечивает совместимости по другим локусам, соседствующим с HLA-A и HLA-B, в отличие от родственников в первом колене, у которых антигены HLA-A и HLA-B являются превосходными маркерами других сцепленных локусов. Степень улучшения приживляемости трупной почки при совместимости по двум А- и двум В-антигенам составляет приблизительно 10%, и, вероятнее всего, такое улучшение обусловлено тем, что некоторые из этих совместимостей будут включать в себя и совместимость по HLA-D-антигенам вследствие неслучайности связи сцепленных аллелей (неслучайное распределение аллелей) в данной популяции (гл. 63). Чем больше расовая гомогенность популяции, тем больше шансов, что любой отдельный маркер будет находиться в неслучайной связи с другим маркером.
Быстро получить результаты СКЛ-реакции (например, в течение 24 ч) невозможно; поэтому используют серологические методы, позволяющие определить приблизительную степень совместимости. Из числа молекул HLA II класса—DP, DQ и DR — последний вид антигенов играет основную роль в СКЛ-реакции; действительно. совместимость по DR обеспечивает наилучшую приживляемость трупных почек.
Суммарные данные по более чем 5000 трансплантаций трупных почек, проведенных во всем мире, показывают, что показатели приживляемости трансплантата повышаются на 20% в случае совместимости по двум антигенам DR по сравнению с теми случаями, когда по обоим этим антигенам наблюдается несовместимость. Кроме того, если имеется также совместимость и по HLA-B-антигенам, показатели приживляемости трансплантатов еще более возрастают. Вероятность получения совместимости по DR-антигенам зависит от готовности и желания трансплантационных центров оценивать органы по этим критериям. При проведении некоторых программ трансплантации была достигнута совместимость по DR-антигенам в 20% случаев. Данные о влиянии циклоспорина на значение совместимости по HLA-B и HLA-DR-антигенам показывают его аддитивную роль. Поскольку улучшению результатов трансплантации способствуют .многие факторы (лечение, определение совместимости, переливания крови), становится все труднее различить, какие именно факторы оказывают дополнительное влияние. Однако еще никем не было заявлено о достижении превышающего 90% показателя успешного приживления трансплантата при, пересадке трупных почек.
Предсенсибилизация. Положительный результат пробы на перекрестную совместимость между сывороткой крови реципиента и Т-лимфоцитами донора, относящимися к антигенам HLA-класса I, служит прогностическим признаком острой сосудистой реакции, называемой гиперострым отторжением. Еще несколько лет назад полагали, что больные, у которых вырабатываются такие антитела против суррогатной панели нормальных лимфоцитов, подвержены высокому риску ускоренного, если не гиперострого отторжения, даже если проба на перекрестную совместимость с донором была отрицательной. Чтобы опровергнуть это, потребовалась большая работа по исследованию биохимических показателей у больных, находящихся на диализе, в ходе которых определяли не только наличие или отсутствие антител, но и HLA-антигены, против которых направлены эти антитела. Больным, у которых вырабатываются aнти-HLA-антитела, можно с большой уверенностью в успехе трансплантировать почку, если тщательно провести пробу на перекрестную совместимость. У больных, длительное время находящихся на гемодиализе, часто наблюдаются колебания титра антител и их уровень иногда, но не всегда, временно связан с переливаниями крови. При получении предназначенной для пересадки трупной почки выполняют работы на перекрестную совместимость с несколькими высокореактивными сыворотками, принимая во внимание ранее отмечавшуюся специфичность антител. Недавно было установлено, что обнаруженные ранее реакции анти-HLA-антител необязательно развиваются вновь через несколько месяцев, когда несовместимый антиген попадает в организм больного при переливании продуктов крови. Действительно, по-видимому, можно игнорировать положительные результаты пробы на перекрестную совместимость с сывороткой, хранившейся в течение нескольких месяцев, если результаты пробы со свежей сывороткой будут отрицательными. Потеря памяти о HLA у больных, находящихся на хроническом диализе, может быть результатом развития у них специфической иммунологической толерантности, обусловленной подавлением активации клеток, или результатом антиидиотипического иммунитета. Предсенсибилизация антителами, представленными на В-лимфоцитах, но не на Т-лимфоцитах, не служит противопоказанием к проведению трансплантации. Некоторые из этих антител являются aнти-DR-антителами, в то время как другие представляют собой нe-HLA-антитела IgM, активные на холоде и при комнатной температуре, но, по-видимому, не оказывающие влияния на приживление трансплантата.
Эндотелиально-моноцитарная система. В некоторых случаях неожиданного ускоренного отторжения были обнаружены антитела, реагирующие на эндотелий почек и моноциты крови; их выявляли как в циркулирующей крови, так и в жидкостях, полученных из отторгнутых трансплантатов. Практическое осуществление типирования и проведения проб на перекрестную совместимость с этой He-HLA-антигенной системой затруднительно. По-видимому, особенно большая опасность отторжения существует при повторной трансплантации после быстрого отторжения первого трансплантата.
Суммарный обзор трансплантационной иммуногенетики. В дополнение к антигенам АВН(О) группа крови в настоящее время известно, что важными антигенами гистосовместимости являются антигены HLA-A, HLA-B, HLA-C, HLA-DR и эндотелиально-моноцитарная антигенная система (табл. 221-2). Самые последние данные позволяют предположить, что основная иммуногенность связана с DR-антигенами, в то время как антигены А, В, С и эндотелиально-моноцитарные антигены служат основными целями для эффектора IgG, а в случае А-, В- и С-антигенов по меньшей мере для Т-лимфоцитов-киллеров. Поэтому в настоящее время основное внимание уделяется пробам на перекрестную совместимость антигенов А, В, С и типированию DR-антигенов.
Переливания крови. В тот период, когда полагали, что индуцированная переливанием крови сенсибилизация к случайной панели лимфоцитов является прогностическим признаком высокой частоты отторжения трансплантата, в ряде трансплантационных отделений была взята на вооружение концепция отказа от переливаний крови как можно большему числу находящихся на диализе больных. Было решено, что клиническая потребность в переливаниях крови больным не столь велика, как считали прежде, и что особенно это справедливо в отношении больных с неудаленными почками; дополнительными соображениями в пользу такого подхода служило и стремление предотвратить возможное заражение больного гепатитом. Суммарный опыт лечения больных без проведения переливаний крови оказался драматичным, что было подтверждено неоднократно впоследствии: у таких больных был самый высокий риск отторжения трансплантата. По-прежнему предметом обсуждения все еще остается число переливаний, необходимое для оптимального приживления трансплантата; большой объем собранных данных указывает на то, что оптимальным является пять или более переливаний, хотя в некоторых исследованиях утверждают, что вполне эффективными оказываются одно—два переливания, проведенные заранее или во время трансплантации. Опубликованные в настоящее время данные не содержат сведений о том, переливалась свежая или замороженная кровь или отмытые клетки крови, а также не указывают, какие именно конкретные методы хранения крови применялись. В этой области, как и во многих других разделах клинической трансплантологии, еще не хватает необходимого количества данных. Тем не менее большое число наблюдений, включенных в проспективные исследования, уже представило собой внушительное суммарное свидетельство о том, что отказ от проведения переливаний крови снижает частоту успешного приживления трансплантата на 20—30%.
Таблица 221-2. Гистосовместимость при трансплантации почек
Относительная важность типирования и перекрестной совместимости для серологически определяемых антигенов
| Антигены | Типирование (антигенная совместимость) | Проба на перекрестную совместимость |
| Класс I (HLA-A, HLA-B, HLA-C) | + | +++ |
| Класс II (HLA-DR) | +++ | |
| Эндотелиально-моноцитарные (не-HLA) | ? | +++ |
Механизмы воздействия переливаний крови неизвестны, но они могут включать в себя избирательный процесс выявления лиц, реагирующих на определенные HLA-антигены, с другой стороны, переливания крови могут вызывать развитие состояний подавления специфических иммунных реакций. Оценка сочетанного влияния переливаний крови и DR-типирования показывает, что они не оказывают аддитивного действия. Если имеется хорошая совместимость по HLA-DR-антигенам, то необязательно проводить предварительное примирование для индуцирования пониженной реактивности. С другой стороны, если больному многократно проводили переливание крови, то перекрестное типирование HLA-DR не принесет дополнительных преимуществ. Переливания крови оказывают благоприятное действие и при использовании гаплоидентичных трансплантатов от живых доноров. В частности, использование крови от предполагаемого донора для трех переливаний перед трансплантацией приводит к наилучшему приживлению трансплантата у тех 70% реципиентов, у которых не развивается сенсибилизации к HLA-антигенам. Отчасти действие переливаний крови состоит в выявлении лиц, не реагирующих образованием антител; кроме того, возможно, что переливания индуцируют специфическую супрессию иммунитета. Предварительные данные о переливании крови от специфического донора показывают, что частота успешного приживления трансплантата в течение 1 года превышает 90%, т. е. находится в диапазоне тех результатов, которые получают в случае HLA-идентичных трансплантатов. Опять-таки, применение циклоспорина может изменить отношение к использованию переливаний крови, но в настоящее время определенные результаты еще отсутствуют.
Иммунология отторжения. Знания об иммунологии трансплантации тканей получены главным образом в экспериментах на животных. Однако уже накоплено достаточно данных, относящихся к человеку (особенно при трансплантации почек), указывающих на то, что иммунные процессы сходны, но не идентичны у животных разных видов. Иммунные механизмы трансплантации не отличаются качественно от механизмов, выявленных в других областях иммунологии (гл. 62). Существуют доказательства того, что раннее отторжение трансплантата связано с действием Т-лимфоцитов, направленным непосредственно и специфически против антигенов донора. Это могут быть цитотоксические клетки (Т8 или Т4) или клетки, опосредующие действие ДТН (Т4); однако в ранних стадиях процесса отторжения в инфильтрате присутствует значительное число В-лимфоцитов, ноль-лимфоцитов, естественных клеток-киллеров (ЕК) и макрофагов; присутствуют также и клетки, способные опосредовать антителозависимую клеточно-опосредуемую цитотоксичность (АЗКЦ) (рис. 221-3). Многие из В-лимфоцитов продуцируют иммуноглобулины. Спектры клеточного и гуморального ответов и повреждения трансплантата довольно вариабельны и зависят от специфических генетических различий между донором и реципиентом и от степени предсенсибилизации. Чем больше степень предсенсибилизации, тем более вероятно, что будут обнаружены опосредуемые через антитела поражения сосудов. Любой из процессов, показанных на рис. 221-3, возможен, но относительный вклад этих процессов различен в каждом конкретном случае. Дальнейшее аналитическое рассмотрение гетерогенности реакции на аллотрансплантат человека с использованием более совершенных методик выявления подклассов лимфоцитов повысит ценность результатов биопсийного исследования трансплантата как ориентира для лечения и прогнозирования. Контролирование подклассов лимфоцитов в периферической крови с помощью моноклональных антител (гл. 62) для функционального связывания поверхности таких молекул, как Т4 (Т-клетки-хелперы) и Т8 (Т-клетки-супрессоры), в некоторых обзорах связывали со степенью активности отторжения, но в действительности величина соотношения Т4/Т8 не всегда имеет клиническое значение. Часть этой проблемы, возможно, заложена в том факте, что эти подклассы лимфоцитов не так однозначно связаны с их функцией, как предполагалось ранее. И наконец, как было показано, цитокинные медиаторы клеточного иммунного ответа (IL1, IL2, IL3, IFN) играют важную роль в контроле и выраженности аллоиммунной реакции отторжения. Например, продуцирование Т-клетками IFN вызывает увеличение экспрессии HLA-антигенов на эндотелиальных клетках. В нормальной иммунобиологии этот процесс может состоять в том, чтобы способствовать более эффективному проявлению инородного антитела, в то время как при трансплантации он увеличивает иммуногенность васкуляризованного трансплантата.
Отторжение трансплантированных почек через 2 или даже 3 года нормального функционирования обусловлено одной из форм «хронического отторжения». В таких почках развивается нефросклероз с пролиферацией внутренней оболочки почечных сосудов, фиброзом, заметным уменьшением просвета сосудов (рис. 221-4). В результате этих изменений возможны ишемия почек, гипертензия, распространенная атрофия канальцев, интерстициальный фиброз и атрофия клубочков, приводящие в конечном итоге к развитию почечной недостаточности.
Иммуносупрессивное лечение. В случае, если между донором и реципиентом существуют различия в гистосовместимости, необходимо модифицировать или подавить иммунный ответ для того, чтобы дать возможность реципиенту принять трансплантат. Иммуносупрессивная терапия в общем подавляет все иммунные реакции, включая реакции на бактерии, грибы и даже на злокачественные опухоли. В 50-е годы, когда только начинали проводить клиническую трансплантацию почек, применяли тотальное облучение больного в сублетальных дозах. В настоящее время достичь подавления иммунного ответа можно с меньшим риском при помощи лекарственных средств. Лекарственные средства и методика, применяемая для подавления иммунного ответа у человека, рассматриваются в последующих параграфах.
Лекарственные средства. Азатиоприн (имуран), представляющий собой аналог меркаптопурина, является основой проведения иммуносупрессивной терапии у человека. Этот препарат может угнетать синтез дезоксирибонуклеиновой кислоты (ДНК), рибонуклеиновой кислоты (РНК) или синтез их обеих. Поскольку деление клеток и их пролиферация являются необходимой частью иммунного ответа на антигенную стимуляцию, супрессивное действие азатиоприна может быть опосредовано через угнетение митоза иммунокомпетентных лимфоидных клеток, нарушая синтез ДНК. С другой стороны, иммуносупрессия может быть вызвана блокированием синтеза РНК (возможно, информационной РНК), вызывающим угнетение процессирования антигенов до стимуляции ими лимфоцитов. Метаболиты азатиоприна блокируют образование розеток Т-клетками с эритроцитами овец. Этот последний феномен вызывается рецепторами на молекуле Т11, которая является частью системы, активирующей Т-клетки. Однако воздействие этого лекарственного средства в отношении подавления вторичного иммунного ответа весьма невелико. Лечение азатиоприном обычно начинают за 2 дня до трансплантации у реципиента, получающего почку от живого донора, и в день трансплантации в случае трансплантации трупной почки с дозы 4 мг/кг в сутки. Позднее эту дозу снижают до 1,5— 3 мг/кг в сутки и назначают прием препарата на весь период функционирования трансплантата. Поскольку азатиоприн быстро метаболизируется в печени, нет необходимости изменять его дозировку в прямой зависимости от функции почек, даже если задержка в организме метаболитов азатиоприна вызовет развитие почечной недостаточности. Некоторые больные обладают необычайно высокой чувствительностью к этому лекарственному средству, особенно при нарушенной функции почек, и уменьшение дозы для них необходимо из-за развития лейкопении или, иногда, тромбоцитопении. Введение избыточных количеств азатиоприна может вызвать желтуху, анемию и алопеции. При необходимости сочетанного введения азатиоприна и аллопуринола дозу первого следует резко снизить, поскольку угнетение ксантиноксидазы замедляет деградацию азатиоприна. Однако лучше всего избегать сочетания этих лекарственных средств.
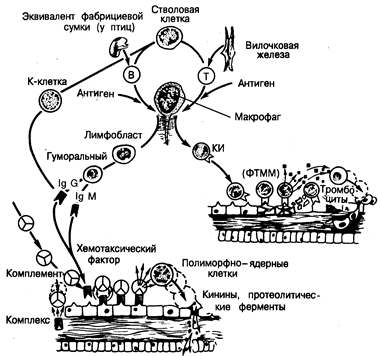
Рис. 221-3. Общая схема развития эффекторных механизмов при отторжении трансплантата.
Стволовые клетки костного мозга дифференцируются под влиянием вилочковой железы в зрелые тимус-производные Т-лимфоциты или, под влиянием эквивалента фабрициевой сумки (у птиц), в зрелые производные костного мозга В-лимфоциты. Контакт с антигеном (А) приводит к взаимодействию Т- и В-клеток, в него часто вовлекаются и макрофаги. После завершения митоза сенсибилизированные В-клетки трансформируются в антителопродуцирующие (плазматические) клетки, представленные на данном рисунке как IgM и IgQ. В циркулирующей крови иммуноглобулины могут образовывать иммунные комплексы с антигеном, способные активировать систему комплемента или реагировать непосредственно с антигенами на поверхности кровеносных сосудов. Выработка вторичных медиаторов, включая продукты активации комплемента, приводит (как показано на рисунке) к повреждению сосудов. Сенсибилизированные Т-лимфоциты являются основными эффекторными клетками клеточного иммунитета (КИ) и могут реагировать непосредственно с антигенами в трансплантате, оказывая цитотоксическое действие. Кроме того, Т-клетки высвобождают такие факторы, как фактор торможения миграции макрофагов (ФТММ), которые могут увеличивать скорость мононуклеарной клеточной инфильтрации. Этот процесс аналогичен реакции гиперчувствительности замедленного типа (ГЗТ). Показано также, что путем фиксации IgG на клетках-мишенях могут быть активированы несенсибилизированные не-Т-клетки (К-клетки), в результате чего проявится их цитотоксическое действие, после чего происходит взаимодействие IgG (его Fc-фрагмента) с рецептором на К-клетке. И наконец, вслед за повреждением эндотелия развиваются агрегация тромбоцитов и тромбоз. Повреждение эндотелия может быть индуцировано любым из перечисленных механизмов.

Рис. 221-4. Биоптат из аллотрансплантата трупной почки; на рисунке показано развитие облитерирующего эндартериита.
Исчезновение средней оболочки связано с разрастанием внутренней оболочки. В эластической соединительной ткани наблюдается растворение эластической оболочки. Видны служащие признаком развития артериита с последующим тромбозом типичные области разрывов в средней и эластической оболочках. Разрастание внутренней оболочки, вероятно, соответствует организации тромба, образовавшегося вследствие артериита. Из: G. J. Dammin, J. P. Merrill, Structural Basis for Renal Disease, E. L. Becker (ed). New York, Hoeber-Harper, 1968.
Глюкокортикоиды — важное дополнительное средство при проведении иммуносупрессивной терапии. Из всех используемых препаратов преднизон оказывает такое воздействие, которое легче всего оценить, и при его использовании в больших дозах он, бесспорно, является самым эффективным лекарственным средством для приостановки процесса отторжения. Обычно 30—40 мг преднизона вводят непосредственно перед или во время трансплантации, а затем эту дозу постепенно снижают. Хорошо известные побочные эффекты глюкокортико идов, в частности замедление заживления ран и развитие предрасположенности к инфекционным болезням, делают желательным снижение дозы как можно быстрее в раннем послеоперационном периоде. Обычно 1—2 г метилпреднизолона вводят внутривенно сразу после того, как будет диагностировано начало отторжения, и продолжают вводить ежесуточно в течение 3 сут. Если препарат эффективен, то результаты его действия обычно проявляются в течение 48— 96 ч. Такое «импульсное» дозирование препарата менее эффективно при медленно текущих процессах отторжения, которые могут не проявляться в течение 2 или 3 лет после трансплантации. Большинство из тех больных, у которых функция почек .стабильна через 6 мес или 1 год после трансплантации, не нуждаются в введении больших доз преднизона; как правило, им назначают поддерживающие дозы в 15—20 мг/сут. Многие больные лучше переносят введение стероидов через сутки, чем ежесуточные дозы; при этом риск отторжения не увеличивается.
Дата добавления: 2015-07-22; просмотров: 926;
