Состав атомного ядра. Массовое и зарядовое числа, размер ядра
Исследование атомных ядер началось после установления следующих экспериментальных фактов: 1) открытие в 1896 году французским учёным Анри Беккерелем естественной радиоактивности; 2) открытие в 1910 году английским учёным Содди изотопии химических элементов; 3) ядерная модель атома, предложенная в 1911 году великим английским физиком Эрнестом Резерфордом.
Резерфорд, исследуя радиоактивность, пришел в 1908 году к выводу, что при радиоактивном распаде происходит превращение атомов одних химических элементов в атомы других элементов. Позже, исследуя прохождение a-частиц с энергией в несколько мегаэлектрон-вольт через тонкие пленки золота, Резерфорд открыл ядерную модель атома, после чего стало ясно, что при радиоактивности имеет место превращение ядер одних элементов в ядра других элементов.
Открытие изотопии сыграло следующую роль. Атомные веса, т.е. массы атомов химически чистых элементов, как правило, выражаются в а.е.м. числами, не очень близкими к целым. Например, атомный вес бора (В) – 10,82; Ne – 20,183; Cl – 35,457; Fe -56,85 ;… . С открытием изотопии утвердилось мнение, согласно которому химически чистый элемент представляет собой смесь изотопов, отличающихся друг от друга атомными весами. Атомные веса изотопов оказались ближе к целым числам, чем атомные веса элементов, причём тем ближе, чем легче изотоп, т.е. чем меньше его атомный вес. Это навело ученых на мысль, что ядро состоит из частиц, атомные веса которых близки к единице. Этому условию хорошо удовлетворяет ядро атома водорода – протон, атомный вес которого близок к единице (1,008). Кроме того, так как заряд протона положителен, то напрашивалась идея, что в состав ядра обязательно должны входить протоны. Другие составные частицы ядра пришлось выяснять довольно долго. Явление естественной β-активности, казалось, свидетельствовало о том, что в состав ядра входят электроны. Поэтому была предложена протонно-электронная модель ядра. Однако протонно-электронная модель оказалась несостоятельной. По этой модели спин ядра, составленного из чётного числа протонов и электронов, должен быть целым (спин протона, как и спин электрона равен ½ ħ ), а на практике наблюдаются и полуцелые числа. Модель не объясняла, почему магнитный момент ядра в 2000 раз меньше магнитного момента электрона. Наконец, протонно-электронная модель оказалась в противоречии с принципом Гейзенберга. Зная размеры ядра, можно оценить величину импульса электрона, входящего в состав ядра, а следовательно, и величину его энергии. Такие оценки дают, что энергия электрона в ядре около 200 Мэв. Согласно эксперименту, энергия связи одной частицы в ядре 7 – 8 Мэв. Кроме того, энергия в 200 Мэв во много раз превышает энергию электронов, испускаемых ядром при β-распаде.
Выход из затруднения был найден после того, как в 1932 году сотрудник Резерфорда, Чадвик, открыл новую элементарную частицу – нейтрон. Масса нейтрона примерно равна массе протона, чуть превышая её, а электрический заряд равен 0. Вскоре после открытия нейтрона, в 1934 году, советским физиком Д.Д.Иваненко была высказана гипотеза о протонно-нейтронном строении ядра. Эта же гипотеза была независимо высказана Гейзенбергом.
В настоящее время протонно-нейтронная структура ядра является общепризнанной и лежит в основе современных представлений о ядре и всей ядерной физики.
По современным данным протон (р) имеет положительный заряд, равный заряду электрода qp= 1,6.10-19 Кл и массу покоя mp= (1,0075957 ± ±0,000001) а.е.м. = (1836,09±0,01) me.
Нейтрон (n) — нейтральная частица с массой покоя mn = (1,008982 ± ±0,000003)а.е.м. = (1838,63 ± 0,01) me, где 1а.е.м.= 1,667.10-27кг – 1/12 массы атома С12 ;
me = 9,106.10-31кг  – масса покоя электрона.
– масса покоя электрона.
В современной физике считается, что протон и нейтрон – два зарядовых состояния одной и той же частицы, которая называются нуклоном (от лат. nucleus - ядро). Итак, протон – протонное состояние нуклона, нейтрон – нейтронное состояние нуклона. Общее число нуклонов в атомном ядре называется массовым числом А.
Атомное ядро характеризуется зарядом Ze, где Z — зарядовое число ядра, равное числу протонов в ядре и совпадающее с порядковым номером химического элемента в периодической, системе элементов Менделеева. Известные в настоящее время 107 элементов таблицы Менделеева имеют зарядовые числа ядер от Z =1 до Z = 107. Так как Z равно числу протонов в ядре, то число нейтронов в ядре равно: N = A – Z. В ядерной физике принято ядро обозначать тем же символом, что и нейтральный атом: 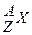 , где Х - символ
, где Х - символ
химического элемента, Z - атомный номер (число протонов в ядре), А— массовое число (число нуклонов в ядре).
Так как атом нейтрален, то заряд ядра определяет в число электронов в атоме. От числа же электронов зависит их распределение по состояниям в атоме, от которого, в свою очередь, зависят химические свойства атома. Следовательно, заряд ядра определяет специфику данного химического элемента, т. е. определяет число электронов в атоме, конфигурацию их электронных оболочек, величину и характер внутриатомного электрического поля.
Ядра с одинаковыми Z, но разными А (т. с. с разными числами нейтронов) называются изотопами, а ядра с одинаковыми А, но разными Z изобарами. Например, водород (Z= 1) имеет три изотопа; 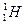 - протий (Z =1, N = 0) ;
- протий (Z =1, N = 0) ; 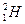 - дейтерий, (Z =1, N = 1);
- дейтерий, (Z =1, N = 1); 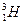 - тритий (Z =1, N = 2).В подавляющем большинстве случаев изотопы одного и того же химического элемента обладают одинаковыми химическими и почти одинаковыми физическими свойствами (исключение составляют изотопы водорода), определяющимися в основном структурой электронных оболочек, которая является одинаковой для всех изотопов данного элемента.
- тритий (Z =1, N = 2).В подавляющем большинстве случаев изотопы одного и того же химического элемента обладают одинаковыми химическими и почти одинаковыми физическими свойствами (исключение составляют изотопы водорода), определяющимися в основном структурой электронных оболочек, которая является одинаковой для всех изотопов данного элемента.
Примером ядер-изобар могут служить ядра: 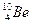 ,
, 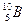 ,
, 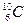 . В настоящее время известно более 2500 ядер, отличающихся либо Z, либо A, либо тем и другим.
. В настоящее время известно более 2500 ядер, отличающихся либо Z, либо A, либо тем и другим.
Резерфорд показал, что атомные ядра имеют размеры примерно 10-14 - 10-15 м (для сравнения, линейные размеры атома примерно 10-10 м). Радиус ядра - задается эмпирической формулой R = R0 A1/3 , где R0 = (1,3÷1,7)10-15 м. Однако при употреблении этого понятия необходимо соблюдать осторожность из-за его неоднозначности, например из-за размытости границы ядра. Объем ядра пропорционален числу нуклонов в ядре. Следовательно, плотность ядерного вещества примерно одинакова для всех ядер: ρ » 1017 кг/м3.
Дата добавления: 2015-07-18; просмотров: 1385;
