ПАТОГЕНЕЗ СИНДРОМА ОСТРОЙ ИШЕМИИ
Знание основных патогенетических механизмов развития острой ишемии тканей при острой закупорке магистральных артерий необходимо для правильной оценки степени ишемии, выбора методов хирургического и терапевтического лечения.
В результате остро возникшей закупорки магистральной артерии развивается спазм периферических сосудов. Механизм развития артериоспаз-ма недостаточно выяснен. В нем 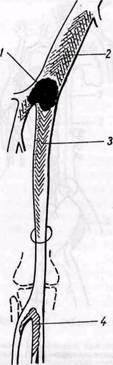
Рис. 154. Схема развития продолженного тромба — восходящего (2) и нисходящего (3) по отношению к эмболу (1), а также вторичного тромбоза (4) дистальных сосудов. Граница восходящего тромба достигает уровня отхождения крупной артериальной ветви
участвуют рефлекторные реакции, влияние кислородного голодания стенки сосудов и эффект действия трансму-рального давления на стенки микрососудов при резком снижении в них давления крови ниже критического уровня. Патологический артериоспазм затрудняет включение коллатерального кровообращения и в этой связи рассматривается некоторыми авторами (Б. А. Долго-Сабуров, 1956, и др.) как основная причина развития необратимых изменений тканей, поскольку препятствует своевременной компенсации нарушенного магистрального кровообращения за счет коллатерального кровотока. Однако в случае продолжительной тяжелой ишемии тканей спазм мелких сосудов, по-видимому, сменяется паралитичес-
кой вазодилатацией вследствие метаболического ацидоза. Диаметр магистральных периферических сосудов, как показывают клинические наблюдения, у большинства больных при ишемии значительно уменьшен. Вследствие нарушения гемодинамики (стаз крови), патологических изменений сосудистой стенки в результате гипоксии и аноксии и изменений свертывающей системы крови развивается продолженный тромбоз в проксимальном (восходящий) и в дистальном (нисходящий) направлении по отношению к месту первоначальной закупорки (рис. 154). Границы продолженного тромбоза обычно ограничены местами отхождения крупных ветвей, в которых сохраняется относительно большая скорость кровотока. В начальной стадии продолженный тромб обычно флотирующий, не спаян с артериальной стенкой и относительно легко может быть удален.
В последующем тромб увеличивается, спаивается со стенкой сосуда, распространяется на ее боковые ветви, мышечные артерии. Развивается воспалительная реакция сосудистой стенки. Вследствие метаболических изменений в тканях возникают микро- и макроагрегаты форменных элементов крови, микроэмболы, тромбозы в мышечных и даже в магистральных венах — у5—6% больных (В. С.Савельев с соавт., 1974). Признаки венозного тромбоза являются показателем того, что кровоток в конечности полностью нарушен. Распространение тромботического процесса на микро-циркуляторное и венозное русло — чрезвычайно неблагоприятный прогностический признак. В таких случаях оперативное устранение причины окклюзии не может быть эффективным, так как после восстановления проходимости магистральных сосудов нормальный кровоток в тканях не наблюдается, возникает вторичный тромбоз магистрального сосуда вследствие высокого периферического сопротивления, затрудненного оттока и патологических изменений стенок сосудов.
Острая непроходимость магистральных артерий приводит к развитию острой аноксии (гипоксии) и нарушению всех видов обмена в тканях. Важнейшее значение имеет развитие метаболического ацидоза, обусловленного переходом аэробного окисления в анаэробный, и накопление избыточного количества недоокисленных продуктов обмена, в частности ПВК и МК. В ишемизированных тканях в большом количестве появляются активные ферменты, например кинины. Выделен также «ишемический токсин» (В. В. Кованов, Т. М. Оксман), точная структура которого и механизм действия недостаточно изучены. Анок-сия и метаболический ацидоз приводят к нарушению проницаемости клеточных мембран, гибели мышечных клеток. В результате этого внутриклеточный калий и миоглобин накапливаются в межтканевой жидкости, попадают в общий кровоток и развиваются гиперкалиемия и «миоглоби-нурический нефроз».
При тяжелой продолжительной ишемии конечности возникает суб-фасциальный отек мышц, обусловленный нарушением проницаемости клеточных мембран и ионного равновесия. Мышцы конечностей заключены в плотные фасциальные и костно-фасциальные влагалища и сдавление их при отеке усугубляет нарушение кровотока в тканях. Это может привести к некрозу целых групп мышц, особенно после оперативного восстановления кровотока в магистральных артериях, поскольку отек ишемизированных мышц резко увеличивается после операции. Установлено, что в сосудах ишемизированных тканей образуются макроагрегаты форменных элементов крови (В. С. Савельев с соавт., 1973, 1975). Метаболические нарушения (ацидоз, активные ферменты), стаз крови, наличие макроагрегатов форменных элементов крови создают условия для внутрисосудис-того тромбообразования в мелких со-
судах, капиллярах, что в конечном счете приводит к развитию необратимых изменений в тканях конечности.
Изменения центральной гемодинамики у больных, в частности снижение артериального давления, ухудшение показателей сердечной деятельности (снижение ударного объема, сердечного индекса), ухудшают и без того нарушенное местное кровообращение.
Чувствительность к аноксии (гипоксии) отдельных видов тканей различна. В первую очередь наступают изменения в нервной и мышечной тканях — уже через 10—12 ч аноксии возникают необратимые патологические изменения. Кожа более устойчивая к кислородному голоданию, необратимые изменения в ней развиваются почти через 24 ч.
Расстройства кровообращения и ишемическое повреждение тканей наиболее выражены в дистальных отделах конечности — чем дистальнее, тем в большей степени. Необратимые изменения в мышцах распространяются гораздо проксимальнее, чем в коже. Ишемическое повреждение отдельных мышечных групп может быть различным.
Дата добавления: 2015-07-18; просмотров: 1615;
