Направленная миграция прогениторных клеток: взаимодействие с радиальной глией
Во время развития нервной трубки радиальная глия (РГ) опережающе возникала из клеток хориоидного сплетения, которые затем мигрировали внутрь нервной трубки. Биполярные клетки РГ устроены асимметрично: перивентрикулярный отросток биполярной клетки, обращенный к эпендиме, обычно укорочен. Противоположный отросток пронизывает всю толщу нервной трубки (растущего мозга) (Chanas-Sacre G., Rogister B., Moonen G. et al., 2000). В растущем мозжечке РГ получила название Бергмановской глии, она служила " рельсами" для миграции клеток Пуркинье к клеткам внутреннего гранулярного слоя. В отличие от РГ остального мозга, которая исчезает в постнатальном периоде, Бергмановская глия функционирует в постнанатальном периоде, когда завершается формирование архитектоники клеточных слоев мозжечка. После завершения миграции нейронов РГ трансформировалась в астроглию. Помимо характерной морфологии, маркерами РГ служили виментин (белок промежуточных нейрофиламентов) и RC2-белок, принимающий участие в транспорте липидов. Специфический контакт РГ с прогениторными клетками опосредовался белком межклеточных узнаваний - астротактином. Нейрегулин (GGF) ускорял миграцию прогениторных клеток вдоль тяжей РГ (Anton E.S., Marchionni M.A.., Lee K.F. et al., 1997). Установлено, что клетки РГ имеют более сложный генез, чем ранее предполагалось. Наиболее ранние порции РГ возникали из стволовых клеток сосудистых сплетений pia mater, мигрирующих в растущую нейропаренхиму. Вторая часть РГ возникала из НСК нейроэктодермы. Третья часть РГ появлялась из клеток нервного гребня и нейромезенхимы (Hartfuss E., Galli R., Heins N. et al, 2001). В коре зародыша часть НСК служила временным источником РГ. В постнатальном периоде клетки РГ превращались в астроглию, реже –нейроны (Noctor S.C., Flint A.C., Weissman T.A. et al., 2001). По этой причине глубокие клеточные слои возникали первыми, тогда как самые поверхностные слои клеток формировались последними. В эпендиме и перивентрикулярной области стволовые пространства используют ликвор в качестве "поддерживающей" среды для выживания. В растущем мозге эмбриона формировались так называемые "мобильные стволовые ниши", когда прогениторные клетки в комплексе с клетками растущих сосудистыз сплетений в синергизме осваивали новые клеточные пространства.
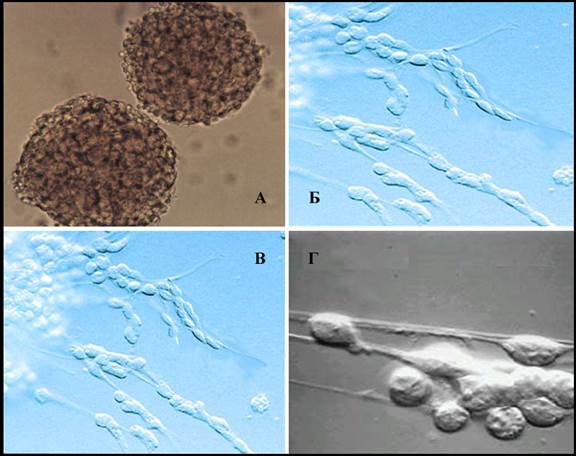
Рис 2-5. Формирование мобильных кластеров НСК/прогениторных клеток на тяжах РГ в культуре ( А- нейросферы в суспензионной культуре, Б,В – тяжи радиальной глии с одиночными мигрирующими прогениторными клетками, Г - участок радиальной глии с мигрирующим кластером прогениторных клеток).
Гипертрофия ядер таламуса мозга человека связана с расширением клеточной сигнализации с фронтальной корой. Этот феномен отсутствовал в онтогенезе мозга лабораторных млекопитающих и приматов. Исследования Rakic показали, что крупные ядра дорзального таламуса возникали не за счет локальной пролиферации, а путем миграции прогениторных клеток из ganglionic eminence развивающегося мозга. Смешанное культивирование эксплантата ganglionic eminence зародыша человека с эксплантатом дорзального таламуса мыши не приводило к миграции прогениторных клеток человека в таламус мыши ( Rao Y., Wu J.Y., 2001)
В гиппокампе взрослых животных новые порции прогениторных клеток мигрировали на растущих капиллярах (РГ к тому времени превращалась в астроциты). Мигрирующие прогениторные клетки распределялись кластерами на монослое эндотелия (Palmer T.D., Willhoite A.R., Gage F., 2000).
Пролиферация и миграция прогениторных клеток - главный феномен, ответственный за быстрый рост мозговой ткани зародыша. В мозговом сегменте нервной трубки человека миграция прогениторных клеток начиналась после первого месяца гестации и в основном завершалась в постнатальном периоде (Rаkic P.,2000).
В мозге эмбриона выделяли два потока мигрирующих прогениторных клеток: 1) радиальный (тангенциальный) по "монорельсам" РГ 2) горизонтальный вдоль клеточных слоев. Соотношение клеточных потоков по радиальному/горизонтальному пути варьировало от 1/9 до 1/4 (Chanas-Sacre G., Rogister B., Moonen G. et al., 2000).
Мутации белка reelin у мышей вели к тяжелым нервным расстройствам, обусловленным нарушением архитектоники клеточных слоев в коре больших полушарий и других структурах мозга. Этот белок регулировал время и место покидания прогениторными клетками РГ. Мутации по липопротеидным рецепторам (VLDLR и apo ER2) приводили к сходным нарушениям направленной миграции прогениторных клеток и нарушениям архитектоники клеточных слоев  (Rakic C., 2000). Алкоголь, действуя на мозг зародыша, разрушал образование РГ. Помимо алкоголя, некоторые мутации вызвали тяжелые аномалии миграции прогениторных популяций в мозговой паренхиме
(Rakic C., 2000). Алкоголь, действуя на мозг зародыша, разрушал образование РГ. Помимо алкоголя, некоторые мутации вызвали тяжелые аномалии миграции прогениторных популяций в мозговой паренхиме
Клоногенная культура НСК/прогениторных клеток, полученная из фетального мозга или мозга эмбрионов млекопитающих, моделировала направленную миграцию прогениторных клеток по остову РГ. Если выращенную в селективной ростовой среде суспензию нейросфер поместить в новую среду, содержащую малые концентрации сыворотки с добавлением ВМР-4, наблюдали формирование вытянутых тяжей биполярных клеток, к поверхности которых прикреплялись кластеры нестин+ или виментин+ клеток (Рис 2-5).
В дальнейшем наблюдали миграцию прогениторных клеток вдоль тяжей РГ. Клетки РГ окрашивались виментином, кадхерином-11, часть клеток фиксировала антитела к GFAP и к поверхностному антигену RС2. Направленную миграцию к зонам повреждения демонстрировали и гематогенные стволовые CD34+ клетки, трансплантированные в мозг взрослых мышей. Для удобства визуализации, гематогенные стволовые клетки были помечены цветным белком GFP. Трансплантированные клетки формировали кластеры прогениторных клеток в ткани мозга (Ono K, Takii T, Onozaki K. et al., 1999).
Дата добавления: 2015-07-18; просмотров: 756;
