Нейромезенхимальные стволовые клетки нервного гребня
Во время нейруляции только млекопитающие формируют уникальный провизорный орган - нервный гребень(НГ) по всему длиннику зародыша - от промежуточного мозга до сакральных сомитов и ниже. НГ состоит из двух тяжей плюрипотентных зародышевых клеток между эктодермой и нервной трубкой, которые возникают за счет сигналов, возникающих одновременно в нервной трубке и прилегающей эктодерме. Клетки будущего НГ мигрируют из нервных складок - растущих концов открытой нервной трубки. Совместная инкубация эксплантатов нервной пластинки и эпидермиса достаточна для образования клеток НГ в обоих кусочках ткани (LaBonneC.,Bronner-Fraser M.,1999). Момент появления клеток НГ определяют по мРНК двух маркерных генов –Slug , Snail, позднее Pax-3. Точную комбинацию сигналов, запускающих появление клеток НГ как in situ, так in vitro пока не удалось определить. Блокада рецепторов для FGF частично приостанавливала появление клеток НГ. Появление гликопротеина Noelin1 на поверхности клеток маркирует первые клоны НГ в нервной трубке. Ретровирусная сверхэкспрессия Noelin1 ведет к длительному образованию и миграции клеток НГ в нервной трубке зародышей млекопитающих (Christiansen J.H., Coles E.G., Wilkinson D.G., 2000)
Показательно, что клетки НГ невозможно получить лабораторным путем – из ЭСК, НСК или клеток первичной эктодеомы. Фетальная ткань мозга остается единственным источником клеток НГ. Еще долгие годы фетальная ткань мозга будет служить источником для выделения уникальных провизорных линий из разных органов. Например, аорта фетусов служит уникальным банком ангиобластов, которые невозможно выделить из других тканей.
В головном отделе из клеток НГ образуются ганглии черепно-мозговых нервов, слуховой, вестибулярный и цилиарный ганлии. Часть клеток головной части НГ идет в стволовые клетки сосудистых сплетений (chorioid plexuses). Значительная часть клеток НГ дифференцируется в астроциты, микроглию и олигодендроциты. Подобно строме эти клетки в дальнейшем вырабатывают ростовые факторы (bFGF,EGF,TGF-alpha, NGF, PDGF, HGF, ILGF-1, NGF, NT3, GGF), адресованные стволовым и прогениторным клеткам (Mentlein R., Kendall M., 1999). Одновременно клетки НГ играют роль "провизорной мезенхимы", поддерживающей развитие среднего и заднего мозга. Локальное удаление головной части клеток НГ вело к массированному апоптозу нейроэпителия и аномалиям прозомеров (Etcheveres H.C., Couly G., Vincent C. et al, 2000 ). Головная часть клеток НГ служила донором стволовых клеток для образования глакомышечных клеток, перицитов всей артериальной и венозной системы лица и шеи (Etchevers H.C., Vincent C., Le Douarin N.M. et al., 2001).
На уровне 1-7 сомитов из НГ формировались ганглии вегетативной нервной системы внутренних органов. Из туловищного отдела НГ возникали чувствительные ганглии спинного мозга, клетки мозгового вещества надпочечников и меланоциты. Миграция клеток НГ происходила по всем сегментам зародыша. Два главных потока мигрирующих клеток шли по вентральной и дорзо-латеральной стороне зародыша в места будущего расположения ганглиев, надпочечников, периферической нервной системы. Антитела к фибронектину, коллагену и ламинину, как и антитела к молекулам адгезии частично подавляли локомоцию клеток in situ. Из пула клеток НГ возникало значительное число меланоцитов как покровных тканей, так и внутренних органах. Клетки НГ возникали в результате эпителио-мезенхимальной трансформации. Эта трансформация сопровождалась экспрессией Нох-генов (Slug, goosecoid, Dlx2, Dlx3, Barx1, dHAND, eHAND). На поверхности стволовых /прогениторных клеток НГ экспонирован рецептор для эндотелина-1 (Clouthier D.E., Williams S.C., Yanagisawa T.E. et al, 2000). Ген Slug остается наиболее универсальным маркером эпителио-мезенхимальной трансформации клеток, поскольку антисенс-олигонуклеотиды мРНК Slug наиболее эффективно её блокировали (LaBonne C., Bronner-Fraser M., 1999). Вторично было блокировано появление миграторных популяций клеток НГ. Экспрессия гена Рах-3 превращала клетки-предшественники НГ во временную линию на период их расселения по организму. Трансфекция и сверхэкспрессия гена Рах-3 приводила к образованию иммортализованных фибробластов, которые давали опухоли в nude - мышах ( Maulbacker, Gruss, 1993). Непосредственной мишенью действия продукта гена Рах-3 является ген Msx-2 - контролер плюрипотентности пролиферирующих незрелых прогениторных клеток НГ ( Kwang S.J., Brugger S.M., Lazik A. et al., 2002). Экспрессия Рах-3 в прогениторных клетках одновременно включала другой ген – Foxd3. Способствуя экспрессии транскриптазе HNK-1 и кадхерину-7, продукт гена Foxd3 усиливал миграцию ранних прогениторных клеток из НГ (Dettori M., Gross M.K., Goulding M., 2001). Популяция мигрирующих предшественников периферической глии маркировалась антителами к транзитину (Henion P.D., Blyss G., Luo B., 2000). Популяция прогениторных клеток НГ, мигрирующих в сердце, маркировалась рецептором для PDGF. Ретиноевая кислота в тератогенных дозах вызывала подавление экспрессии «навигационных» рецепторов и запускала аномалии миграции клеток НГ in situ ( Li J., Molkentin J.D., Colbert M.C.,2001).
Для эпителиомезенхимальной трансформации характерно изменение спектра поверхностных молекул адгезии. Если в центре клона промиграторные клетки плотно сцеплены молекулами N-кадхерина, то мигрирующая популяция прогениторных клеток НГ экспонировала кадхерин-6 и кадхерин-11 (Simmoneau L., Kitagawa M., Suzuki S. et al, 1995). Во время эпителио-мезенхимальной трансформации в клетках головной части НГ активировался Нох-7 ген. Характерно, что у части клеток хориодного сосудистого пучка, которые мигрировали в головной мозг и встраивались в слой эпендимы, происходила активация близкого Нох-7 гена (MacKenzie A., Ferguson M.W., Sharpe P.T., 1991).
Пересадки плюрипотентных клеток проамниона (внеэмбриональной эктодермы) между эктодермой и нервной трубкой зародыша также вели к появлению клеток НГ из клеток трансплантата. Это доказало решающую роль сигналов микроокружения в первичном возникновении клеток НГ. Обнаружен критический период, когда концентрация сигналов, способствующих образованию клеток НГ, достигала максимума (Ruffins S., Bronner-Fraser A.M., 2000). Локальные инъекции SHH блокировали появление эндотелин-позитивных и Slug+ прогениторных клеток. Noggin, Bmp-4, BMP-7 не влияли на появление клеток НГ. Как в случае нервной трубки, появление первых клонов стволовых клеток НГ было сопряжено с активацией одного из Sox- генов (Sox-10). Гены этого семейства отвечают за плюрипотентность стволовых клеток (Cheng Y., Cheung M., Abu-Elmagd M.M. et al., 2000 ). Промиграторные прогениторные клетки клонов НГ также сохраняли плюрипотентность. Подтверждением служил тот факт, что клоны плюрипотентных клеток НГ удалось выделить как из периферических нейронов симпатической парасимпатической НС, так и периферических ганглиев. Мигрируя на десятки см на периферию, часть прогениторных клеток сохраняла мультипотентность. Однако большинство одиночных мигрирующих клеток, покидающих клон, сохраняли более ограниченную коммитацию к дифференцировке.
Клетки головного отдела НГ мигрировали дорзовентрально, формируя костно-мышечный и хрящевой каркас, соединительную ткань лицевого черепа и шеи (включая хрящи гортани, уха, внутреннего уха, строму тимуса, нейроэпителий щитовидной железы, зачатки зубов). Взаимодействия мигрирующих клеток головной части НГ и эпителия тимуса приводили к локальной экспрессии транскрипционных факторов Hoxa3, Pax1 и Wnt, необходимых для созревания вилочковой железы. Внутриутробные аномалии развития и дефект миграции клеток НГ ответственны за развитие некоторых врожденных иммунодефицитов (типа синдрома DiGeorge).
Клетки НГ, расположенные между миотомами и спинальным отделом нервной трубки, были донорами клеток ганглиев периферической симпатической и парасимпатической нервной системы, проводящей системы и клапанов сердца, нейросекреторных клеток надпочечников, гладкомышечных клеток артерий, меланоцитов кожи, чувствительных нейронов спинного мозга, шванновских клеток. Сегментация НГ на отделы шла с помощью eph-лиганда и eph- рецепторов. Граница раздела сегментов НГ, как и в нервной трубке, проходила по бислою eph-R- eph-L клеток. Пересаженные клетки НГ от раннего зародыша перепела в мозг зародыша крысы мигрировали в кости и мышщы лицевого черепа, пока территории мозга не были поделены бислоями клеток содержащих пару eph-R-eph-L. Клетки зародыша перепела более поздних сроков развития мигрировали в сердце, вегетативные ганглии тонкого кишечника и кожу (меланоциты) крысы-реципиента.
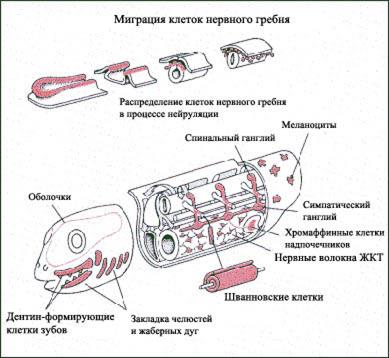
Рис 2-10. Миграция и распределение клеток нервного гребня
Экспрессированные гены AP-1, Wnt-1 Wnt-3 служили маркерами миграторных популяций НГ. Рост клонов НГ имел как признаки сходства, так и отличия от роста клонов НСК эктодермального происхождения. В отличие от суспензионных клонов НСК, большинство клонов НГ прикреплялось к подложке.
Клоногенная культура клеток НГ оказалась мультипотентной: из общего пула незрелых клеток удавалось получить нейроны, глию, шванновские клетки (периферические олигодендроциты), гладкомышечные клетки, хондроциты, остеобласты, миобласты. В то же время из клоногенной культуры НСК не удавалось получать клетки НГ. Не известно, остаются ли какие-либо «резервы» незрелых клеток НГ в мозге взрослых животных и человека. Клоны НГ in situ сохраняли мультипотентность, поскольку «ядро» клона было изолировано слоями плотно собранных прогениторных клеток. Мультипотентность клонов НГ в культуре была меньше, чем при их трансплантации. Например, клоны НГ in vitro не дифференцировались в нейроны парасимпатических кишечных ганглиев. Однако они формировали химерный ганглий из донорских/реципиентных клеток при локальной пересадке в рыхлую соединтельную ткань тонкого кишечника. В то же время только клоны НГ из головного мозга дифференцировались в мышцы и кости лица, а также строму тимуса in situ.
В середине эмбриогенеза нейроэпителиальная выстилка спинного мозга крысы сохраняла клоны провизорных клеток, из которых возникали как клоны НГ , так и суспензионные клоны НСК. Поэтому принято думать, что часть общих некоммитированных предшественников сохраняется в спинном мозге со стадии нервной трубки. В культуре только ВМР-2, ВМР-4 стимулировали образование клонов НГ из спинального нейроэпителия зародышей крыс. Не исключено, что высокое содержание ВМР-2, ВМР-4, генерируемое аортой, влияло на автономный нейрогенез цепочки симпатических ганглиев из мигрирующих клеток НГ. Автономный нейрогенез ганглиев из пришлых прогениторных популяций НГ имел место в сердце, лёгких, где локальная концентрация ВМР высока, как и в аорте.
Клетки НГ в клонах экспрессировали N-кадхерин и кадхерин-6. Мигрирующие прогениторные клетки, покидавшие клон, окрашивались кадхерином-7 и кадхерином-11. Мигрирующие клетки НГ отличались экспрессией нового класса сигнальных G-белков - Rho ГТФ-азы. Смена молекул адгезии на поверхности клеток НГ происходила с помощью экспрессии двух Нох-генов: Msx1 и Msx2 (Linecum J.M., Fannon A., Song K. et al., 1998). Региональное включение Msx-1 , Msx-2 опосредовало множество функций, в том числе закладку зубных зачатков и отростков верхнего нёба. Эти гены экспрессировались также в межфаланговой ткани конечностей, которая подвергалась апоптозу. В эпидермисе кожи, волосяных фолликулах гены Msx-1/Msx-2 контролировали численность клеток (число клеточных слоев) в ткани. Экспрессия кадхерина-11 связана с появлением нового белка внутри клеток - бета-катенина, медиатора сигналов через кадхерин-11. Появление бета-катенина подготавливало почву для включения генов семейства Wnt.
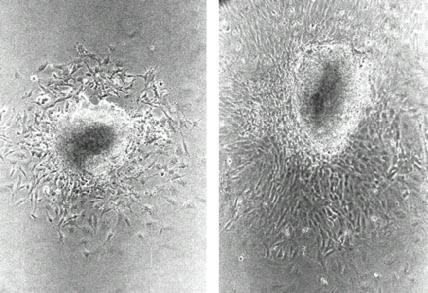
Рис 2-11 Фазово-контрастная микроскопия клеток НГ в культуре
Клоногенный рост стволовых клеток НГ связан с тремя феноменами 1) самообмениваемостью клеток 2) рестрикцией дифференцировки прогениторных клеток 2) апоптозом, селектирующим выживание части прогениторных клеток. Если на уровне обновления и рестрикционной дифференцировки превалировал "инструкционный" механизм, то апоптоз использовал селекцию для отбора клеток. Без апоптоза невозможно регулируемое самообновление прогениторных клеток в клоне. Максимальную скорость пролиферации имели клоны, где соседние слои прогениторных клеток удерживались Delta-Notch взаимодействиями (Maynard T.M., Wakamatsu Y., Weston J.A., 2000 ). Три изоформы гена (Notch1, Notch2, Notch3) обеспечивали уникальную комбинацию рецепторов как на поверхности прогениторных клеток нервной трубки, НГ, сомитов, так и других производных экто-мезодермы (за исключением энтодермы) (Williams R., Lendhal U., Lardelli M., 1995 ). Серийный анализ генной экспрессии в клонах НГ показал, что максимально экспрессируется мРНК Notch/Delta. Как и в случае НСК-клонов нейроктодермального происхождения Delta-Notch контакты являлись главным "вето" на остановку пролиферации прогениторных слоев. Плотная стыковка прогениторных клеток через Delta-Notch защищала клоны от «случайного» нейрогенеза. Нейрегулин стимулировал пролиферацию прогениторных клеток в нейросфере (Calaora V., Rogister B., Bismuth K., 2001). Механическая диссоциация сфер клеток НГ приводила к утрате плюрипотентности прогениторных клеток (Dorsky R., Moon R.T., Raible D.W., 2000). Особенность клонов НГ состояла в том, что стимуляция Delta-Notch, блокируя нейрогенез, активировала созревание шванновских клеток в периферических ганглиях (Morrison S.J., Perez S.E., Z.Qiao et al, 2000).
Методом конечных разведений было доказано, что диссоциированные прогениторные клетки содержат клон-инициирующие клетки. Фенотипически идентичные промиграторные прогениторные клетки имели разную генетическую потенцию. Фенотипическая гетерогенность прогениторных клеток внутри клонов сочеталась с высокой пластичностью клеток, которая проявлялась при трансплантации.
Нейрогенез из плюрипотентных клеток НГ шел через ту же цепочку генов, что и нейрогенез из НСК нервной трубки: коэкспрессия Wnt-1/Wnt-3 необходима для экспансии прогениторных популяций. В ряде ситуаций в цепочку включался Mash1 (для некоторых специализированных линий в сочетании с нейрогенинами -Ngn1,Ngn2) (Ikeya M., Lee S.M., Jihnson J.E. et al., 1997). Комбинации TGF-beta, BMP-2, BMP-4, bFGF, EGF индуцировали дифференцировку прогениторных клеток НГ в сенсорные нейроны, нейроны вегетативных ганглиев, гладкомышечные клетки, клетки проводящей системы.
Phox2b запускал дифференцировку прогениторных клеток НГ в адренэргические нейроны ганглиев. Через последнюю транскриптазу активировалась экспрессия генов ферментативной цепи окисления тирозина в гидрокси - медиаторы. Точные комбинации сигналов для индукции моноспецифической дифференцировки не опубликованы в открытой печати. Клоны НГ, изолированные из головного мозга, имели максимальную потенцию к дифференцировке в нейроны. Клоны НГ, изолированные из ростральных отделов спинного мозга чаще всего дифференцировались в меланоциты.
В случае дифференцировки прогениторных клеток НГ в меланобласты у клеток формировался сложный комплекс рецепторов для длительной навигации. Во-первых, экспонировался рецептор с-kit для SCF. Мигрирующие предшественники меланоцитов вырабатывали SCF, который разрозненные клетки собирал в пласт . Часть клеток содержала два новых рецептора ( c-kit- рецептор тирозиновой киназы и рецептор эндотелина-3 одновременно) (Guo C., Wherle-Haller B., Rossi J. et al., 1997). Многие клетки экспрессировали рецептор для PDGF. Синхронно активировалась экспрессия Wnt1, Wnt3a, а также транскриптазы MITF, необходимых для включения цепочки генов синтеза меланина (Pou L., Panthier J.J., Arnheiter H., 2000). Трансгенные мыши с лишней дозой гена Wnt-1 имели гиперпигментацию кожи за счет увеличения численности меланоцитов. В прогениторных клетках НГ, мигрирующих в проводящую систему миокарда, активировалась транскриптаза HAND1 (Riley P.R., Gersenstein M., Dawson K. et al, 2000).
Подавляющая часть шванновских клеток периферической нервной системы возникала из стволовых клеток НГ. Сами резервы стволовых клеток для генерации новых шванновских клеток сохранялись в нервных волокнах, частично в спинном мозге. В эмбриогенезе первые предшественники олигодендроцитов в спинном мозге появлялись у зародышей человека 45 дня развития ( Rogister B., Ben-Hur T., Dubois-Dalcq M.,1999). Предшественники олигодендроцитов экспрессировали рецептор для PDGF. Характерен фокальный рост предшественников. Как in vitro , так и in vivo образование предшественников олигодендроцитов запускалось SHH. На первом этапе прогениторные клетки чаще созревали в астроглию, если в микроокружении преобладали следующие сигналы: PDGF, BMP-2/4, CNTF. Комбинация PDFG+ bFGF, или PDGF+GGF направляли рестрикционную пролиферацию прогениторных клеток в сторону олигодендроцитов. Переход к постмитотическому созреванию клеток связан с экспрессией р27 и р21 –ингибиторов циклин-зависимой киназы (Cdk). Механизм запуска миелинизации остается нерасшифровнным. Комбинация Т3 и IGF-1 запускала экспрессию генов белков миелина. Если активировался ген MBP (myelin basic protein) и PLP, то ингибировался ген Krox-24. Трансплантация предшественников олигодендроцитов в боковые желудочки резко увеличивала число донорских миелин+клеток в зонах демиелинизации мозга крыс. В отличие от НСК, предшественники олигодендроцитов более эффективно мигрировали по белому веществу и накапливались в участках демиелинизации ( Learish R.D., Brustle O., Zhang S.C. et al., 1999).
Важные последствия получил метод выделения высокоочищенной клоногенной культуры клеток НГ (Stemple D.L.,Anderson D..J.,1992, Morrison S.J., White P.M., Anderson D.J. et al, 1999). С помощью иммуносортинга культуру клеток НГ удалось до 80% обогатить стволовыми/прогениторными популяциями, удалив примесь эндотелия, гладкомышечных клеток, перицитов, шванновских и других «продвинутых» клеток. Стволовые клетки НГ удалось изолировать из нескольких источников: мозга зародышей, периферических нервов, из дорзальных ганглиев. Селективная среда, содержащая ростовые факторы, позволила значительно обогатить культуру прикрепленными к подложке клонами. Важнейшим поверхностным маркером стволовых клеток НГ является белок р75 - рецептор ростового фактора NTF3. Эта же популяция стволовых клеток не прокрашивалась антителами к периферину (Р- фенотип) - одному из белков шванновских клеток. Выращенные в культуре клоны НГ отличались выраженной гетерогенностью. Миграторные прогениторные клетки прикреплялись к пластику и давали характерный монослой распластанных клеток.
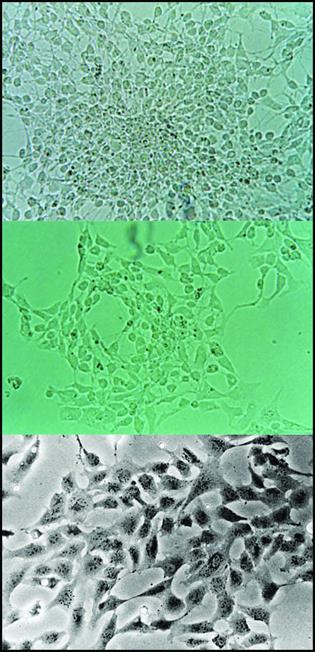
Рис 2-12. Преконфлуентная культура прикреплённых нейромезенхимальных клеток под фазовоконтрастным микроскопом.
Часть клонов удавалось многократно пассировать, причем клетки внутри сфер сохраняли : а) способность инициировать клонообразование, б) плюрипотентность (способность дифференцироваться в нейроны, глию, шванновские клетки, миофибробласты и даже хрящ. Обычно клоны НГ в культуре подвергались смешанной дифференцировке. Моно-дифференцировка клонов НГ в культуре в нейроны шла с помощью комбинации ВМР-2 и ВМР-4. ВМР индуцировал экспрессию Mash-1 в постмитотических клетках. Монодифференцировку клонов НГ в глию получали добавлением GGF (нейрегулина). Гладкомышечные клетки из прогениторных популяций НГ получали добавлением TGF-beta. Glial growth factor (GGF) - митоген и индуктор образования шванновских клеток - ингибировал дифференцировку прогениторных клеток НГ в нейроны. При пересадке клонов стволовых клеток НГ в мозг зародышей донорские клетки ограниченно дифференцировались в холинэргические нейроны как в головном мозге, так и на периферии (White P.M., Morrison S.J., Orimoto K. et al., 2001). Другие исследователи также отмечали ограниченную пластичность клонов НГ при их пересадке в мозг и другие ткани реципиента (по сравнению с клонами НСК, выделенных из перивентрикулярных отделов мозга) (Shah N.M., Anderson D.J., 1997). Исключение составляли стволовые клетки нейроэпителиальной выстилки спинного мозга, которые содержали предшественники ЦНС и клеток периферической нервной системы. В общей массе изолированных клеток встречались клоны, которые прокрашивались как на нестин, виментин, так и Р75 (Mujtaba T., Mayer-Proschel M., Rao M.S., 1998 ). Предполагается, что часть стволовых клеток спинальной части НГ мигрировала в нервную трубку. Поэтому потенции к регенерации спинного мозга выше, чем головного мозга за счет химеризации клетками нейромезенхимы.
Важно подчеркнуть, что потенции стволовых клеток НГ в генерации костно-хрящевых структур черепа, тимуса, щитовидной железы, ганглиев, проводящей системы сердца уникальны и не могут быть замещены другими фетальными клетками. Пересадки НСК эктодермального происхождения не в состоянии заменить функций прогениторных клеток НГ. Вторая важнейшая особенность прогениторных клеток НГ - это высокая скорость и плотность миграции клеток на рекордные расстояния. Уникальные возможности нейромезенхимальных клеток в плане направленной миграции в организме привлекают внимание медиков с целью репарации клеточных дефектов тимуса, уродств костно-мышечной системы лица, а также репарации проводящей системы сердца.
Поскольку периферическая часть нервной системы формирует значительное число адренэргических нейронов для симпатических ганглиев и коры надпочечников, актуальными остаются поиски " программ", эффективно управляющих монодифференцировкой постмитотических прогениторных клеток НГ. Практически каталогизирован список генов-участников : Ret, Phox2a, Phox2b, ген тирозингидроксилазы (Young H.M., Ciampoli D., Hsuan J. et al., 1999).
Наследственные дефекты миграции клеток НГ только начали изучаться. Например наследственная болезнь Ваарденбурга связана с дефектами пигментации кожных покровов и отсутствием вегетативных ганглиев в кишечнике на почве мутации рецептора к эндотелину-3 (Newgreen D.F., Murphy M., 2000 ). В настоящее время стволовые клетки НГ нашли новое неожиданное применение в лечении наследственной мышечной дистрофии, обусловленной дефектом гена дистрофина. Хорошо известно, что у пациентов с дистрофией Дюшенна избирательно поражаются мышцы конечностей, но не лица, глаз и гортани. Оказалось, что вся мышцы лица и шеи, возникшие из клеток НГ, синтезируют утрофин (эмбриональный дериват дистрофина) для функции. Поэтому все мышцы лица и шеи пациентов оcтаются неповрежденными. В настоящее время предпринимаются пересадки фетальных миобластов, лабораторно полученных из клеток НГ с целью реконструкции мышц пациента из донорских клеток, резистентных к заболеванию. (Black H., 2000). Для целей трансплантации получены первые бессмертные линии стволовых клеток НГ (Rao M.S., Anderson D.J., 1997).
Дата добавления: 2015-07-18; просмотров: 1383;
