Нейрональные стволовые клетки in vitro
Терминология и главные характеристики НСК существенно зависели от способов выделения, молекулярной идентификации и функциональных тестов. В культуре НСК вели себя как самообновляющиеся в клонах незрелые плюрипотентные клетки с набором селективных фенотипических признаков. После остановки пролиферации они дифференцировались в нейроны, глию и олигодендроциты ( Price J., Williams B., 2001). При этом потенция к трансдифференцировке НСК in vivo в случае их пересадок животным был всегда больше, чем их потенциал in vitrо. Сигналы микроокружения в ткани играли решающую роль в сульбе трансплантированных клеток.
В 1990 г австралийские биологи во главе с Перри Бартлеттом впервые предложили метод селективного выделения клоногенной культуры НСК из мозга эмбрионов и взрослых животных. С помощью бессывороточной среды, содержащей LIF, bFGF и другие кофакторы, удалось на первом этапе культивирования избавиться от более продвинутых примесных клеток (Murphy M., Drago J., Bartlett P.F., 1990). Это был решающий методический успех, поскольку смешанное культивирование НСК и дифференцированных клеток вело к быстрой гибели, либо спонтанной дифференцировке НСК. Эта группа первой описала особенности роста и дифференцировки суспензионных клонов НСК/прогениторных клеток, а также первой получила иммортализованную линию НСК мышей с помощью трансфекции онкогена c-myc (Bartlett P.F., Reid H.H., Bailey K.A. et al, 1988). В отличие от "природных" НСК, иммортализованные с помощью онкогенов линии стволовых клеток переставали расти клонами. Через два года Reynolds и Weiss использовали близкий подход для выделения суспензионной клоногенной культуры НСК, добавляя в среду сразу два ростовых фактора (EGF, bFGF). Характеристики полученных культур, особенности роста клонов НСК в главном совпали с результатами Бартлетта (Reynolds B.A.,Weiss S.,1992). В 1994 г. Davis и Temple первыми количественно и качественно охарактеризовали клоны НСК, выделенные из мозга эмбрионов крыс. Лишь 7% клонов быстро обновлялись, продуцируя более 60 % всех клеток культуры. Около 40 % клеток в клонах составляли некоммитированные плюрипотентные клетки, которые в специальных условиях дифференцировались в нейроны, астроглию или олигодендроциты. Выращивая клетки в максимальных разведениях, удалось подсчитать примерное число клон-инициирующих клеток. Все клонобразующие клетки экспрессировали нестин - белок промежуточных филаментов нейроэпителия. Характерно, что все клоны НСК с максимальной скоростью обновления прогениторных клеток имели максимальный уровень экспрессии мРНК гена Hes-1 – главного фактора плюрипотентности НСК (Nakamura Y., Sakakibara S., Miyata N., 2000). Экспрессия гена Hes-1 связана с самообновляемостью плюрипотентных клеток в нейросферах. Путем механического разбивания нейросфер, авторам удалось получить вторую и третью генерацию колоний. Клетки клонов после трех пассажей сохраняли плюрипотентность. Авторы выявили гетерогенность клеток нейросфер по чувствительности к ростовым факторам. Цитокины ВМР-2 и ВМР-4 вызывали дифференцировку прогениторных незрелых клеток в нейроны in vitro.
Природная гетерогенность клеток в нейросферах, изолированных из эмбрионального мозга млекопитающих, была отмечена в первых же работах Маркерные молекулы нейроэпителия (виментин, нестин, polysyalated-NCAM, GFAP, CD133 и др ) прокрашивали разные субпопуляции клеток нейросфер (Ushida N., Buck D.W.,Weismann I.L. et al., 2000). В нейросферах из фетального мозга человека антитела к нестину и СD133 прокрашивали до 30-50% клеток. Как известно, СD133 является маркером гематогенных стволовых клеток. Некоторые культуры НСК удалось пассировать без онкомодификации (только на комбинации ростовых факторов в течение 2-3 лет) (Zhou F.C., Chiang Y.H., 1998). Доля клонов в культуре широко варьировала (0,1%- 25% в расчете на общую численность клеток) (Hulspas R., Quesenberry P.J., 2000). С помощью набора ростовых факторов (bFGF, SCF, EGF, LIF. ILGF-1) и своевременной дезагрегации удалось поддерживать и размножать клоногенную культуру плюрипотентных НСК в течение 1-3 лет без утери основных биологических характеристик незрелых плюрипотентных клеток (Carpenter M.K., Cui X., Hu Z., et al., 1999; Kallos M.S.,Behie L.A.,1999; Kallos M.S., Behie L.A., Vescovi A.L.,1999). Добавление к среде культивирования LIF (20-50 нг/мл) уменьшало время удвоения клеточной массы с 25-30 до 10 дней ( Carpenter M.,патент США No6103530). Такие длительно пассируемые культуры НСК не только сохраняли фенотип, плюрипотентность in vitro, но и уникальную способность направленно мигрировать, находить участки повреждениой ткани, интегрироваться в дефект нейронной сети in situ. В ряде случаев это приводило к полному/частичному восстановлению утраченной функции ЦНС (Rubio F.J., Bueno C., Villa A. et al, 2000). Первыми в онтогенезе мозга млекопитающих появляются так называемые f-нейросферы, пролиферация которых зависит только от bFGF. На более поздних стадиях развития появляются e-f-нейросферы, пролиферация которых более зависима от EGF , чем от bFGF ( Ciccolini, 2001).
Из эмбрионального и взрослого мозга человека выделяли клоногенную культуру НСК с фенотипом астроглии (Laywell E.D., Rakic P., Kukekov V.G. et al., 2000). Около 5-7% свежеизолированных нейросфер содержали Notch1+ прогениторные клетки. Эти же авторы выделяли жизнеспособные нейросферы из длительно хранившейся нервной ткани (4-6 дней при +4 С).
НСК с фенотипом астроглии (GFAP+ клетки) чаще всего локализованы в субэпендимальном слое желудочков. При изолировании и культивировании до 60% НСК/прогениторных клеток из перивентрикулярной зоны мозга элиминируются апоптозом (Levinson S.W., Rothstein R.P.,Brazel C.Y. et al., 2000). Низкие цифры жизнеспособности клеток в первичной культуре или пассажах могут быть связаны с присутствием нейросфер с высокой скоростью обновления клеток. Не только фетальная мозговая ткань может быть источником НСК. Кора больших полушарий постнатального мозга является богатым источником нейросфер и прогениторных популяций, инициирующих образование клонов в культуре (Mehler M.F., Gokhan S., 1999). Даже хирургические биоптаты позволили регулярно изолировать НСК из мозга оперированных людей любой возрастной группы ( Kukekov V.G., Laywell E.D., Suslov O. Et al.,1999). Отработана методика сортировки нейросфер по фенотипу с последующим изучением "профиля" мРНК с помощью ПЦР. Метод позволил сопоставить наборы мРНК в нейросферах разного фенотипа или разного происхождения (Suslov O.N., Kukekov V.G., Laywell E.D. et al., 2000). По нашим
данным, нейросферы, выделенные из фетальной мозговой ткани 8-12 нед и 17-21 нед гестации, характеризовались весьма выраженной морфологической гетерогенностью (средними размерами клонов и формой клеток в клонах), гетерогенностью иммунофенотипа ( варьирующим процентом нестин+, виментин+, N-кадхерин+, кадхерин-11+, NCAM+, GFAP+ клеток в разных клонах).
В культуре процент примеси более продвинутых клеток в изолированных нейросферах не превышал 1-2% (по уровню CD34+, MHCI, MHCII + клеток) (Ржанинова А.А., Репин В.С. и др., 2001).
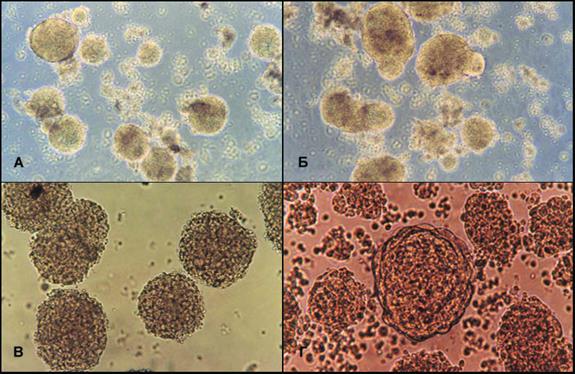
Рис 2-6. Гетерогенность клонов НСК из фетального мозга
На всех фотографиях заметна морфологическая гетерогенность клонов, по форме и упаковке клеток в клонах.
Количество нестин+, виментин+, кадхерин11+ , GFAP+ клеток сильно варьировало в первичной суспензионной культуре и трех первых пассажах. Относительная доля указанных маркеров не изменялась существенно при пассировании и колебалась в пределах 5-25%. Ни в одной первичной культуре нейросфер не наблюдали превалирования монофенотипа до уровня 40-60% от всех клеток нейросфер. Этот постоянный полиморфизм подтверждал «пластичность» нейросфер, собранных
из разных нейроэктодермальных и нейромезенхимальных плюрипотентных клеток. Возможно это природное разнообразие прогениторных клеток с разным набором мРНК и фенотипических маркеров обеспечивает плюрипотентность клона, которая всегда больше, чем одна линия НСК. Пока не ясно, как реализуется это преимущество в эмбриогенезе мозга. Однако «репертуар» НСК максимален в развивающемся мозге человека.
При длительном культивировании и в пассажах наблюдали отпочковывание новых клонов из старых, а не только рост клонов за счет экспансии периферических слоев прогениторных клеток.
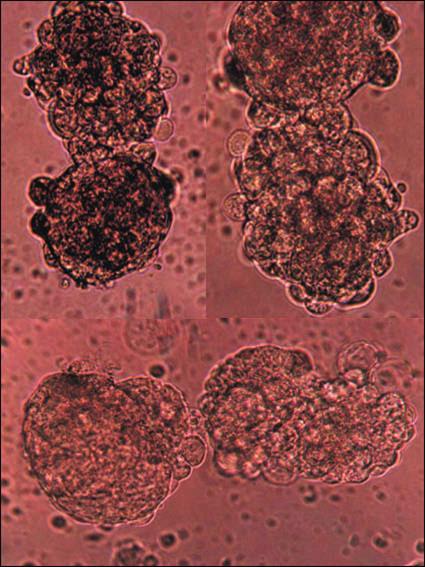
Рис 2-7. Появление новых суспензионных клонов НСК отпочковыванием при высоких плотностях культивирования
В плотной культуре наблюдали отпочковывание новых колоний из выросших крупных нейросфер. Этот феномен пока мало изучен, поскольку затруднено его моделирование in vitro.
Похожие феномены отпочковывания клон-инициирующих клеток наблюдали в культуре изолированных крипт фетального тонкого кишечника при попытке получения клоногенной культуры эпителия тонкой кишки фетуса ( Рис 2-8)
Часть клонов в культуре прикреплялась к подложке с помощью крупных распластанных клеток, имеющих фенотип стромальных. Этот феномен был описан ранее в лаборатории Gottlieb при получении нйеронов из клеток тератокарциномы ( Bain G., Kitchens D., Yao M. et al.,1995) . Стимулируя нейрогенез в эмбриоидных телах с помощью ретиноевой кислоты и других добавок, авторы наблюдали опережающей миграцию крупных распластанных по подложке клеток. Далее на их поверхности появлялись клетки типичной формы с отростками, которые имели набор маркеров нейробластов. Авторы не определили природу этих клеток. Однако эффективность нейрогенеза была выше в тех зонах миграции, где появлялись бислойные участки культуры.
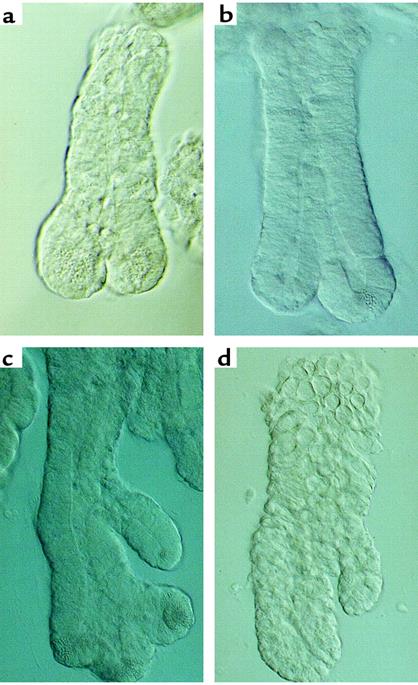
Рис 2-8 Процесс отпочковывания новых клон-инициирующих центров в изолированной крипте тонкого кишечника, выделенной в культуру. Такие фрагменты крипт с двумя и несколькими центрами пролиферации продолжали процесс выделения новых стволовых ниш в культуре.
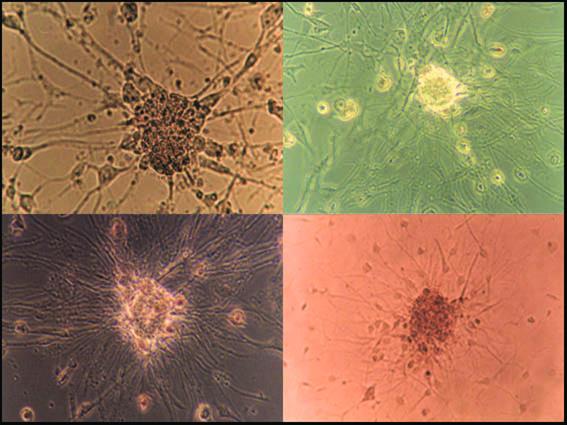
Рис 2-9. Спонтанная дифференцировка прогениторных клеток в клонах, прикреплённых к подложке
Комбинация T3, PDGF LIF индуцировала дифференцировку прогениторных клеток в олигодендроциты. Особенность роста клонов в культуре связана с тем, что все клоны с разной скоростью росли до стадии равновесия (renewal), когда число пролиферирующих клеток уравновешалось числом гибнущих и мигрирующих клеток, покидающих клон. Одним из важных маркеров прогениторных клеток, отличающих их от НСК, является формирование электровозбудимой мембраны, в частности появление кальцевых и натриевых токов, регистрируемых техникой patch-clamp (Piper D.R., Mujtaba T., Rao M.S. et al., 2000). В условиях культуры отношение bFGF+EGF/BMP-4 регулировало как общую численность, так и долю прогениторных клеток в нейросферах. Без ВМР-4 оба митогена давали максимальный прирост клеток в нейросферах, тогда как повышение концентрации ВМР-4 в среде останавливало
пролиферацию, стимулировало апоптоз и постмитотическую дифференцировку клеток, особенно с периферии клонов (Lillien L., Raphael H., 2000). Изолированные в культуру нейросферы экспрессировали три изоформы рецептора (Erb2,Erb3, Еrb4), причем мРНК Erb2 и Erb4 максимальна в прогениторных слоях. In situ максимальную концентрацию мРНК Erb2, Erb4 выявляли в перивентрикулярной зоне и герментативном слое развивающегося мозга крыс (Kornblum H.I., Yanni D.S., Easterday M.C. et al., 2000).
В культуре гетерогенных нейросфер, спонтанно прикрепляющихся к подложке, мы наблюдали опережающую миграцию cadherin-11+ вытянутых биполярных клеток. Позднее вдоль тяжей этих клеток мигрировали типичные ошаренные прогениторные клетки (либо миграция шла целым кластером клеток). Образование клеток радиальной глии из прикрепленных нейросфер, выделенных из коры постнатального мозга человека, наблюдали независимо в лаборатории Clive Svendsen ( Caldwell M.A., He X., Wilkie N. et al.,2001). Для этого выросшие нейросферы помещали на подложку полилизин/ламинин и давали сферам прикрепиться. После этого стимулировали миграцию клеток комбинацией NT,CNTF,PDGF. Клетки возникающей радиальной глии с типичными маркерами опережающе мигрировали из сфер.
Нет однозначных представлений по поводу фенотипа и микроокружения НСК , выделяемых из разных отделов головного и спинного мозга. Согласно некоторым данным, превалирующая часть НСК в растущем и зрелом головном мозге локализована в эпендиме латеральных желудочков ( Momma S., Johanssen C.,Frisen J., 2000). Среди изолированных DIL-меченых эпендимальных клеток только 6% формировали нейросферы. Примерно 3 - 5 % клеток из этой суспензии окрашивались антителами к нестину или Notch 1.
Дата добавления: 2015-07-18; просмотров: 1011;
