| ЭФФЕРЕНТНАЯ ТЕРАПИЯ ИНФЕКЦИОННЫХ ЗАБОЛЕВАНИЙ
ОБЩИЕ ПОЛОЖЕНИЯ
ИНВАЗИВНЫЕ МЕТОДЫ ЭФФЕРЕНТНОЙ ТЕРАПИИ
НЕИНВАЗИВНЫЕ МЕТОДЫ ЭФФЕРЕНТНОЙ ТЕРАПИИ
ОБЩИЕ ПОЛОЖЕНИЯ
Эфферентная терапия (от латинского efferens — выводить) направлена на выведение из организма токсических и балластных веществ, метаболитов и осуществляется главным образом с помощью медико-технических систем.
Эндогенная интоксикация, свойственная большинству инфекционных заболеваний, является основной точкой приложения эфферентных методов. Влияние эфферентной терапии на патологические процессы не исчерпывается прямой детоксикацией. При некоторых состояниях целью применения эфферентных методов лечения является необходимость коррекции иммунологических нарушений (путем выведения избытка циркулирующих иммунных комплексов, иммунокомпетентных клеток, аутоантител). Практическое значение имеет также возможность направленной коррекции белкового и водно-электролитного состава крови.
Эфферентную терапию следует с полным основанием относить к этиопатогенетическим методам лечения, поскольку возможно связывание и удаление не только микробных токсинов, но и самих бактерий и вирусов. Вместе с тем такая терапия эффективна только в комплексе с обычным этиотропным и поддерживающим лечением соответственно нозологической форме заболевания.
Эфферентная терапия реализуется инвазивными (экстракорпоральная гемокоррекция и фотомодификация крови) и неинвазивными (энтеросорбция) методами.
ИНВАЗИВНЫЕ МЕТОДЫ ЭФФЕРЕНТНОЙ ТЕРАПИИ
К экстракорпоральной гемокоррекции (ЭГ) относятся трансфузиологические операции направленного количественного и качественного изменения клеточного, белкового, водно-электролитного, ферментного, газового состава крови во внеорганизменном перфузионном контуре кровообращения.
Эти изменения на сегодняшний день реализуются с помощью мембранной, сорбционной, центрифужной, электромагнитной и преципитационной технологий обработки крови. Предтечей современной ЭГ является операция заменного переливания крови, заключающаяся в эксфузии 300—500 мл крови с последующим замещением адекватным объемом донорской свежезаготовленной крови. Циклы гемоэксфузии и гемотрансфузии повторяются до достижения объема выведения 5—7 л крови. К достоинствам операции заменного переливания крови относят возможность проведения ее без специальной аппаратуры в условиях любого стационара. Существенными недостатками считаются слабый детоксикационный эффект, трудности заготовки больших количеств одногруппной крови и трансфузиологические осложнения, в связи с чем этот метод ЭГ в настоящее время практически не применяется.
Гемодиализ — метод детоксикации, основанный на принципе диффузионного и фильтрационного переноса через полупроницаемую мембрану низкомолекулярных токсических субстанций, электролитов и внутрисосудистой жидкости из циркулирующей экстракорпорально крови в диализирующий раствор. В настоящее время под аппаратом для гемодиализа (как и для других экстракорпоральных операций) понимают монитор, систему магистралей и массообменное устройство — диализатор, который и определяет качественные характеристики гемодиализа. Основные синдромальные показания к применению гемодиализа:
» острая почечная несостоятельность любого генеза, изотоническая гипергидратация при заболеваниях сердца, печени, почек, неправильного плазмозамещения при неэффективности интракорпоральной дегидратации;
» гиперкалйемия вследствие недостаточности функции почек, надпочечников, избыточного применения антагонистов альдостерона или калийсодержащих растворов при неэффективности традиционной терапии;
» азотемия продукционного и (или) ретенционного генеза на фоне недостаточности функции почек.
Следует подчеркнуть, что бикарбонатный гемодиализ лучше переносится больными и предпочтительнее ацетатного гемодиализа, особенно при необходимости коррекции ацидоза у больных с ОПН.
Гемофилыпрация и ультрафильтрация. Гемофильтрация и ультрафильтрация — методы детоксикации, основанные на принципе фильтрационного переноса жидкости и некоторых токсических субстанций через полупроницаемую мембрану из циркулирующей экстракорпорально крови за счет градиента давления. При этом, если в качестве массообменных устройств применяют диализаторы, мембрана которых имеет коэффициент фильтрации 2,5—70 мл/мин, операция носит название «изолированная ультрафильтрация» или «сухой диализ»; в случае использования гемофильтров, мембрана которых имеет коэффициент фильтрации 90—140 мл/мин, операция называется «гемофильтрация». Соответственно, если при ультрафильтрации из крови выводятся ионы и низкомолекулярные вещества, при гемофильтрации выводятся вещества низкой и частично средней молекулярной массы, а объем выводимой жидкости таков (до 5—7 л/ч), что требует адекватного инфузионного замещения специальными растворами типа гемофильтразола фирмы «Фрезениус» или приготовляемыми из стандартных солевых концентратов в специальных мониторах для гемодиализа и гемофильтрации типа «АК-200 ультра» производства фирмы «Гамбро». В соответствии с основными направлениями применения гемофильтрации (как метода, альтернативного гемодиализу у больных с хронической почечной недостаточностью и как метода «продолжительной спонтанной гемофильтрации» при сердечно-сосудистой недостаточности и почечной несостоятельности) разработаны и выпускаются гемофильтры двух категорий, отличающиеся площадью поверхности мембраны, рекомендуемым объемным кровотоком и, соответственно, объемом фильтрации. Для гемофильтров используют мембраны в виде полых волокон из полисульфона и полиамида.
Мониторы для проведения аппаратной гемофильтрации снабжены балансировочным устройством, позволяющим вводить количество жидкости, адекватное выведенному из крови. В качестве замещающей среды применяют полиионные сбалансированные растворы. Спонтанная гемофильтрация обеспечивает выведение 500—600 мл жидкости в час, для ее проведения в артериовенозном варианте не требуется специальной аппаратуры.
Показания для применения изолированной ультрафильтрации — отечный синдром и гипергидратация вследствие заболеваний сердца, почек, неправильного плазмозамещения при неэффективной традиционной терапии.
Показания для применения гемофильтрации:
» острая почечная несостоятельность любого генеза;
» острые отравления спиртами, техническими жидкостями;
» изотоническая гипергидратация при заболеваниях сердца, печени, почек, неправильного плазмозамещения при неэффективности медикаментозной дегидратации;
» эндотоксикоз хирургического и терапевтического генеза при недостаточности функции печени, почек и (или) неэффективности интракорпоральных методов детоксикации.
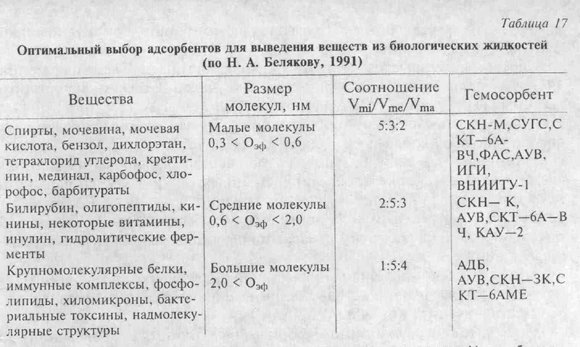
Гемосорбция (гемокарбоперфузия) — метод детоксикации, основанный на выведении из крови больного токсических субстанций путем перфузии через адсорбенты в экстракорпоральном контуре. Для сорбции наиболее часто применяются активированные угли и ионнообменные смолы. Сорбционные характеристики этих веществ по отношению к основным токсическим субстанциям представлены в табл. 17.
Основные показания для проведения гемосорбции — тяжелые генерализованные формы инфекционных заболеваний; тяжелые эндотоксикозы хирургического и терапевтического генеза.
Лимфосорбция — метод экстракорпоральной гемокоррекции, основанный на дренировании грудного лимфатического протока, эксфузии и фракционной сорбции лимфы с последующим ее введением в сосудистое русло. Удаление значительного количества лимфы для достижения детоксикационного эффекта оказалось нередко неблагоприятным для больного в силу невозможности полной компенсации составных частей удаляемой лимфы и клеток, что нарушало белковый и иммунный гомеостаз таких больных. В 1974 году Ю. М. Лопухин и соавт. и Р. Т. Панченков и соавт. впервые одновременно опубликовали результаты разработки и применения в клинике метода лимфосорбции.
Таблица 17
Оптимальный выбор адсорбентов для выведения веществ из биологических жидкостей
(по Н. А. Белякову, 1991)
В основе активной детоксикации за счет дренажа грудного лимфатического протока и лимфосорбции лежит удаление маркеров начальной токсинемии и факторов вторичной токсической агрессии, которые попадают в лимфу грудного лимфатического протока из очагов и должны дренироваться этой системой.
Основными показаниями к лимфосорбции считаются:
» острые деструктивные процессы в брюшной полости с эндогенной интоксикацией в стадии аутоагрессии и гомеостатической несостоятельности тяжелый деструктивный панкреатит, разлитой гнойный перитонит;
» печеночная недостаточность и несостоятельность с выраженным
цитолизом гепатоцитов или значительным холестазом;
» сепсис с очагом в брюшной, плевральной полостях.
Ликворосорбция — это операция внеорганизменной фракционной или непрерывной обработки ликвора с применением активных гемосорбентов. Возможные показания к ликворосорбции — менингоэнцефалиты с замедленной спонтанной санацией ликвора (с высокой мутностью ликвора, протеинорахией и гипогликорахией).
Плазмаферез, плазмосорбция, цитаферез. Плазмаферез — метод экстракорпоральной гемокоррекции, основанный на замене плазмы больного электролитными растворами, препаратами крови и (или) кровезаменителями. Плазмаферез в объеме, превышающем 50% объем циркулирующей плазмы, носит название плазмообмена.
Термин «плазмаферез» (apheresis — удаление) предложен Abel et. al. в 1914 году для обозначения избирательного удаления плазмы из организма. Впервые в клинике плазмаферез был применен Waldensrom в 1944 г. Широкое распространение метод получил с 70-х гг. благодаря разработке фракционаторов крови и мембранных плазмофильтров.
Плазмаферез в силу больших возможностей варьирования методик его проведения (скорость, объем перфузии, объем и качество плазмозамещения, трансфузионная и медикаментозная программа) может иметь детоксикационную, иммунокорригирующую и реокорригирующую направленность. В связи с этим основными показаниями к проведению плазмафереза являются:
» тяжелые декомпенсированные стадии эндотоксикоза различного генеза (после ранений, травм, термических поражений, отравлений, радиационных поражений и др.);
» тяжелые генерализованные формы инфекционных заболеваний;
» хронические аутоиммунные заболевания (бронхиальная астма, системные заболевания соединительной ткани, гематологические заболевания и др.);
» хронический эндотоксикоз при заболеваниях печени, почек, легких;
» тотальный гемолиз и миолиз при отравлениях гемолитическими ядами, синдроме сдавления и др.
Если при плазмаферезе выведенная плазма не замещается компонентами крови или кровезаменителями, а сорбируется и реинфузируется — такая операция носит название «плазмосорбция». Плазмосорбция может быть неселективной (применение в качестве сорбентов активированных углей), полуселективной (применение ионообменных смол) и селективной (применение иммуносорбентов или аффинных сорбентов). С целью активной детоксикации плазмосорбция редко применяется изолированно, однако она часто дополняет плазмаферез. Такая комбинация (плазмаферез + плазмосорбция) целесообразна при всех вышеизложенных показаниях, связанных с эндотоксикозом.
Цитафврвз — метод экстракорпоральной гемокоррекции, основанный на выведении определенных клеточных компонентов крови больного и замене их компонентами, препаратами крови и (или) кровезаменителями. Различают следующие варианты цитафереза: эритроцитаферез, тромбоцитаферез, лимфоцитаферез, гранулоцитаферез, стемаферез (выведение стволовых клеток крови). Как правило, цитаферез дополняет специфические эффекты действия плазмафереза.
Гемоксигенация — метод гемокоррекции, основанный на изменении состава крови путем ее оксигенации при перфузии в экстракорпоральном контуре.
В зависимости от массообменного устройства различают пузырьковую, пленочную, мембранную оксигенацию и оксигенацию с помощью фторорганического переносчика кислорода. Наиболее физиологичной представляется мембранная оксигенация. По объемной скорости перфузии различают высокопоточную (применяется в аппаратах искусственного кровообращения для замещения функции легких) и малопоточную, которая применяется для экстракорпоральной гемокоррекции. Малопоточная гемоксигенация редко применяется как изолированная операция, чаще всего она используется для потенцирования детоксикационного и реокорригирующего действия гемосорбции, плазмосорбции, плазмафереза.
Основные показания к применению гемоксигенации:
» тяжелые декомпенсированные стадии эндотоксикоза различного генеза (после ранений, травм, термических поражений, отравлений, радиационных поражений и др.);
» тяжелые генерализованные формы инфекционных заболеваний;
» респираторный дистресс-синдром взрослых;
« тяжелые пневмонии.
Перитонеальный диализ — метод детоксикации, в основе которого лежит диффузионный и фильтрационный перенос через живую мембрану — брюшину низко-, среднемолекулярных токсических субстанций и жидкости из внутри- и внесосудистого пространства в естественно существующую полость брюшины. С помощью этой технологии можно удалять из крови и всей внутренней среды организма прежде всего экзогенные и эндогенные водорастворимые вещества.
Показаниями к применению перитонеального диализа считаются:
» хроническая почечная недостаточность;
» острая почечная недостаточность и несостоятельность;
» профилактика прогрессирования эндотоксикоза при деструктивных процессах в животе (перитонит, панкреатит).
При проведении курса лечения могут применяться как один, так и сочетание методов ЭГ и даже меняться интенсивность и направленность эффекта принципиально одного метода. Более того, в ряде случаев для достижения желаемого результата необходима комбинация методов гемокоррекции в одном экстракорпоральном контуре, позволяющая либо потенцировать основную направленность ЭГ, либо достигать сочетанной направленности, либо нивелировать нежелательное действие изолированной операции.
Фотогемотерапия представляет собой дозированное облучение крови квантами света длиной волны от 280 до 680 нм (верхняя часть ультрафиолетового спектра и видимый свет). Вызываемое фотонами возбуждение биомолекул и функционально-структурные изменения форменных элементов крови приводят к существенной активации лейкоцитов, факторов неспецифической резистентности организма, изменению проницаемости мембран и запуску опосредованных каскадных фотохимических реакций. Считается, что коротковолновое облучение крови (до 400 нм) обусловливает в основном иммунокорригирующий эффект, а длинноволновое облучение оптического диапазона существенно улучшает реологические свойства крови и микроциркуляцию.
Фотогемотерапия в клинической практике реализуется методами трансфузии аутокрови (АУФОК) или внутрисосудистым облучением крови (ВФОК) как самостоятельно, так и в комбинации с методами ЭГ. Для инфекционных больных, исходя из эпидемиологических соображений, предпочтительна методика ВФОК, так как компоненты оптических систем, контактирующие с кровью, используются однократно.
В методике АУФОК используют аппараты «ИЗОЛЬДА», «Надежда», ультрафиолетовый облучатель ОКН-11 и гелий-неоновые лазеры. При этом кровь больного забирают во флакон с консервантом типа «Глюгицир», а облучение проводят при реинфузии аутокрови со скоростью 20—40 мл/мин. Объем облучаемой за сеанс АУФОК крови составляет 2—5 мл/кг. Курс лечения составляет 5—10 сеансов, по одному сеансу ежедневно или через день.
В методике ВФОК используют ультрафиолетовый кварцевый облучатель ОВК-3 (модели 3,4,5), лазерные облучатели типа «Шатл», «Атолл», АЛТ-101, АЛО.К-1.
ВФОК проводят путем введения световода через иглу или катетер, как правило, внутривенно. Кончик световода должен находиться на уровне среза иглы и постоянно омываться изотоническим раствором натрия хлорида. Длительность сеанса определяется временем, необходимым для облучения 20% объема циркулирующей крови и составляет 30—60 мин при использовании периферических и 10—15 мин при использовании центральных вен. После сеанса световод удаляют и продолжают инфузионную терапию.
Показаниями к фотогемотерапии считают: бактериальные осложнения инфекционных заболеваний (пневмонии, синуситы и пр.), переход в хроническую форму, затяжную реконвалесценцию при вирусных гепатитах с активным цитолитическим синдромом.
Организация ЭГ инфекционным больным. Операции ЭГ осуществляют специально обученные врач и операционная сестра. Они проводятся в операционной или реанимационной палате, оборудованной и оснащенной в соответствии с требованиями ведения больных, находящихся в критическом состоянии, наличием следящей и лечебной аппаратуры, аппаратов и устройств для гемокоррекции, соответствующих медикаментов и инфузионных сред, возможностью проведения сердечно-легочной реанимации. Операционная должна быть оснащена аптечкой, содержащей средства для оказания неотложной медицинской помощи.
При подготовке и проведении экстракорпоральных операций необходимо строго соблюдать требования асептики. Особое внимание следует уделять предупреждению контактного инфицирования при рассечении трубок и монтаже кровепроводящих магистралей. Персонал, выполняющий операцию, работает в операционной одежде (халаты, костюмы), шапочках, перчатках и масках.
Предоперационное обследование больного, кроме патогномоничных критериев, определяющих характер основной патологии, требующей применения эфферентной терапии, должно включать:
» клинический осмотр больного с оценкой состояния жизненно важных функций (сознание и поведение, дыхание, кровообращение, характер гидратации и темп диуреза, цвет кожных покровов, запах);
» полный клинический анализ крови с определением содержания
тромбоцитов и показателя гематокрита; » определение группы и резус-принадлежности крови больного;
» анализ крови на RW, ВИЧ-носительство и HbS-антиген;
» определение концентрации сывороточного белка и по возможности — альбумина;
» определение основных показателей свертывания периферической венозной крови (времени свертывания или рекальцификации крови, протромбинового индекса, концентрации фибриногена плазмы крови, фибриногена Б или этанолового теста, спонтанного фибринолиза, толерантности к гепарину, антитромбина III).
Минимально необходимый объем лабораторного обследования при проведении экстренных операций ЭГ включает в себя определение времени свертывания и длительности кровотечения, числа эритроцитов и тромбоцитов, протромбина, фибриногена, группы крови.
Методические принципы проведения операций ЭГ (по К. Я. Гуревичу, 1995). Операция ЭГ состоит из следующих этапов:
» непосредственная премедикация;
» сосудистый доступ;
» гемодилюция;
» стабилизация крови;
» основная часть операции;
» завершение операции;
» послеоперационное поддержание и развитие достигнутого эффекта гемокоррекции.
Првмедикацию назначают по показаниям больным, находящимся в тяжелом состоянии или в состоянии средней тяжести при выраженных эмоциональных реакциях на обстоятельства проведения операции, при психомоторном неконтролируемом возбуждении и выраженном болевом синдроме. Как правило, она включает анальгетик (опиоидные или ненаркотический препарат), антигистаминный препарат (димедрол, дипразин, тавегил), транквилизатор (сибазон, феназепам). При нестабильной гемодинамике и большом объеме заполнения экстракорпорального контура, которые нельзя компенсировать инфузионной гемодилюцией, показаны прямые кардиотоники (изопротеренол, допамин, добутамин). Медикаментозная коррекция гемодинамики может проводиться параллельно с регидратацией и гемодилюцией.
Сосудистый доступ для подключения аппаратов или устройств экстракорпоральной гемокоррекции осуществляется в зависимости от вида операции и предполагаемого способа гемоперфузии путем пункционного канюлирования или катетеризации вен и артерий. Лишь в отдельных случаях с необходимостью частого и длительного проведения экстракорпоральных операций предварительно выполняют малую ангиохирургическую операцию с вшиванием артериовенозного шунта или созданием артерио-венозного соустья. Различают следующие доступы для проведения экстракорпоральных операций, зависящие от взятия крови для гемокоррекции и ее возврата в организм, которые определяются не только характером операции, но и состоянием больных: вено-венозный, вено-артериальный, артериовенозный. В некоторых случаях может применяться вено- или артериопортальный доступ.
Гемодшюцию проводят в случаях гиповолемии с гемоконцентрацией (показатель гематокрита более 0,45, содержание гемоглобина более 140 г/л).Внутривенная инфузия при этом составляет 10—20 мл/кг массы тела больного. Инфузионная программа определяется индивидуально с учетом состояния больного, вида патологии и включает низкомолекулярные коллоидные растворы (гемодез, желатиноль, реополиглюкин) в сочетании с кристаллоидными инфузионными средствами (лучше сбалансированными) в соотношении 1:3. У больных, находящихся в критическом состоянии или с сопутствующей хронической недостаточностью кровообращения, темп инфузии определяется реакцией ЦВД на инфузионную нагрузку и в функционально благоприятных условиях должен составлять 400-600 мл/ч и более. У больных с гиповолемией без гемоконцентрации и дегидратации инфузионную подготовку к экстракорпоральной операции осуществляют в основном за счет вливания коллоидных растворов (альбумин, гемодез, желатиноль) до исчезновения клинических проявлений гиповолемии.
Стабилизацию крови осуществляют раствором гепарина из расчета 50—350 ЕД на 1 кг массы тела больного (на одну операцию). При необходимости (длительная операция у больного с признаками гиперкоагуляции и тромбофилии) антикоагулянт вводят повторно в половинной дозе. В некоторых случаях суммарная доза гепарина для системной стабилизации крови за операцию может достигать 600 ЕД/кг массы тела. Гепаринизация при проведении экстракорпоральной гемокоррекции может быть общей, региональной или комбинированной. При общей гепаринизации гепарин с целью стабилизации крови может вводиться внутривенно больному непосредственно перед операцией, а при необходимости повторно по ходу работы. При региональной гепаринизации препарат инфузируется постоянно капельно в экстракорпоральный перфузионный контур. Иногда для региональной стабилизации крови в основном при операциях афереза, в качестве антикоагулянта применяют 4% раствор натрия цитрата, такая методика требует введения адекватного количества препаратов кальция. Комбинированная методика включает предварительную гепаринизацию из расчета 70—150 ЕД/кг массы тела (примерно 5—10 тыс. БД) с последующим капельным введением антикоагулянта в экстракорпоральный контур.
Основная часть операции определяется видом и патогенетической направленностью конкретной операции.
Завершение операции экстракорпоральной гемокоррекции состоит, при необходимости, в проведении инфузионно-трансфузионной и медикаментозной терапии, корригирующей изменения внутренней среды, создаваемые самой операцией. Компенсируется существенный эритроцитарный и плазменный дефицит, нормализуется электролитное и кислотно-основное равновесие крови, восстанавливается активность свертывающей системы.
Контроль эффективности восполнения волемии по ЦВД, а при необходимости по реакции на малую дозу ганглиолитиков или показателям центральной гемодинамики, позволяет скорригировать необходимый объем завершающей инфузии, которая должна включать как кристаллоидные инфузионные (лучше сбалансированные), так и коллоидные кровезаменители в соотношении 1:2. При концентрации плазменного белка ниже 54 г/л переливают белковосодержащие кровезаменители (растворы альбумина, протеин). После гемодиализа и гемосорбции на фоне значительной анемии переливают по крайней мере одну дозу (200 мл) отмытых или свежеконсервированных эритроцитов. В случаях резкого снижения коагуляционного потенциала крови (время свертывания по Ли-Уайту более 25 мин) показано проведение нейтрализации избытка гепарина протамин-сульфатом: на 3000—5000 ЕД введенного за экстракорпоральную операцию гепарина вводят примерно 1 мл 1% раствора протамин-сульфата в виде капельной инфузии или микроструйной инъекциис повторным контролем времени свертывания.
У нестабильных по гемодинамике больных в программу завершения экстракорпоральной операции желательно включить вливание поляризующей смеси (раствора Лабори) с инсулином, что позволяет уменьшить стрессорное воздействие операции на организм, если этому нет соответствующих противопоказаний.
Послеоперационное закрепление и поддержание достигнутого гемокорригирующего и организменного эффекта определяется характером патологии, по поводу которой проводилась экстракорпоральная детоксикация. Оно состоит в восстановлении концентрации патогенетически действующих медикаментов (антибиотики, химиотерапевтические средства, глюкокортикоиды, дезагреганты и реокорректоры и др.), а также в использовании медикаментозной терапии (антигипоксанты, актопротекторы) и методов активной детоксикации с целью закрепления эффекта, достигнутого на основной гемокорригирующей операции (курс инфузии детоксикационных кровезаменителей, форсированный диурез, энтеросорбция и т. д.).
Кратность операций определяется достигнутым эффектом и последующим дренирующим действием предыдущей операции. В случаях острых экзотоксикозов повторные операции могут проводиться через 12-18 ч, при тяжелых острых эндотоксикозах первые две операции проводят подряд через 18-24 ч с последующим повторением при необходимости через 2—3 дня. При затяжных и хронических эндотоксикозах кратность и частота операций определяется особенностями патологического состояния, по поводу которого применяют эфферентную терапию. Как правило, в этих обстоятельствах она проводится курсом на протяжении 1-3 нед с кратностью 2—8 экстракорпоральных операций.
ЭГ абсолютно противопоказана инфекционным больным, находящимся в терминальном состоянии, а также с признаками внутреннего или наружного кровотечения. Относительным противопоказанием считают критическое снижение коагуляционного потенциала крови (про-тромбин менее 30%, число тромбоцитов менее 80 тыс в мкл, фибриноген менее 1,0 г/л).
НЕИНВАЗИВНЫЕ МЕТОДЫ ЭФФЕРЕНТНОЙ ТЕРАПИИ
К неинвазивным сорбционным методам относят методы детоксикации и метаболической и иммунологической коррекции, в процессе проведения которых не осуществляется прямой контакт сорбента с кровью. У инфекционных больных практическое применение нашла гастроинтестинальная энтеросорбция.
Гастроинтестинальная сорбция чаще реализуется путем приема препаратов per os, реже — через назогастральные или назоинтестинальные зонды. Первый путь приема препарата предпочтителен при большинстве заболеваний, когда больной в состоянии осуществлять глотательный акт и нет опасности длительной задержки сорбента из-за динамической или механической непроходимости желудочно-кишечного тракта. Второй способ предусматривает введение зонда в желудок или тонкую кишку с фракционным введением и выведением сорбента.
Сорбенты. В качестве энтеросорбентов используют активированные угли медицинского назначения (карболен, карбактин, АУВ «Днепр», СКТ-П, белосорб, ваулен, СКН-П , ВНИИТУ-1 и др.), пористые полимеры растительного и природного происхождения ( полисорб МП, полифепан, лигносорб, пектины и др.), ионообменные материалы (холестирамин, вазозан), синтетические полимеры (энтеродез, энтеросорб). Выбор сорбентов зависит от конкретных задач терапии, способа введения, переносимости больными терапии и других условий. При инфекционной патологии наиболее эффективны сорбенты, способные связывать не только токсины, и бактериальные клетки (активированные угли и препараты на основе лигнина). Оптимальная суточная дозировка для большинства сорбентов при приеме препаратов per os составляет 0,5—1,0 г/кг массы тела. Эта доза делится на 3—4 приема и принимается, как правило, натощак. Длительность энтеросорбции при острых заболеваниях — 3—5 дней, при хронических — до 10—14 дней с последующими перерывами в 7—10 дней.
Общие принципы применения. Энтеросорбция может назначаться по синдромальному принципу до установления этиологического диагноза. При острых инфекционных заболеваниях эффективность энтеросорбции существенно повышается в случае применения ее в первые часы (дни) болезни. По степени детоксикации энтеросорбция в течение 1—2 дней сопоставима с однократной экстракорпоральной геморрекцией. Так же как и другие методы эфферентной терапии, энтеросорбция не заменяет, а дополняет обычное этиотропное и патогенетическое лечение. По сравнению с экстракорпоральной гемокоррекцией, сфера применения энтеросорбции при инфекционной патологии гораздо шире и охватывает легкие и среднетяжелые формы вирусных гепатитов, тифопаратифозных заболеваний, диарейных инфекций, лептоспирозов и др. Комбинация этих методов при тяжелом течении генерализованных инфекций обеспечивает потенцирование эффекта. Показания к применению представлены в табл. 18.

|



