Лекція 1. Корпускулярно-хвильовий дуалізм речовини
Розділ1. Елементи квантової фізики
1.1.1. Ядерна модель атома. Теорія Бора і її суперечності.
1.1.2. Гіпотеза й формула де Бройля. Дослідне обґрунтування корпускулярно-хвильового дуалізму речовини.
1.1.3. Співвідношення невизначеностей. Межі використання законів класичної фізики.
1.1.1.Ядерна модель атома. Теорія Бора і її суперечності
До кінця 19-го сторіччя атом вважали неподільним. Однак відкриття цілого ряду нових фізичних явищ поставили це ствердження під сумнів. На початку 20-го сторіччя було висунуто кілька моделей будови атома. За допомогою цих моделей учені пробували пояснити ряд незрозумілих експериментальних фактів ― лінійність спектрів випромінювання газів при високій температурі, електричну нейтральність і стійкість атомів.
Першу спробу побудувати теорію будови атома в межах класичної фізики зробив у 1903 р. англійський фізик Д. Томсон. За гіпотезою Томсона атом уявлявся у вигляді сфери, яка рівномірно заповнена позитивним зарядом, в середній частині якої містяться електрони. Проте ця модель була неспроможна пояснити спектральні закономірності атомів. За цією гіпотезою число ліній у спектрі не повинно було перевищувати число електронів у атомі, тоді як в дійсності навіть у спектрі атома водню число ліній перевищувало 30. Крім того, гіпотеза Томсона не спиралась на будь-які дослідні дані.
Вирішальне значення для теорії будови атома мали досліди Резерфорда, який у 1913 році вивчав розсіяння пучка a-частинок при проходженні їх через тонку металеву фольгу. Ці досліди показали, що при проходженні через фольгу переважна більшість a-частинок зазнає дуже незначних відхилень, але знаходиться чимале число і таких частинок, які зазнають дуже великих відхилень на кут більший 150°. Таке значне розсіяння a-частинок могло статися тільки під дією позитивного заряду атома. Електрони, маса яких майже у 8000 разів менша від a-частинки, не могли помітно вплинути на її рух. Проходження переважної більшості a-частинок указували на те, що розміри позитивного заряду атома повинні бути значно меншими від розмірів атома. Знаючи заряд атома q = Ze можна було визначити для різних кутів розсіювання так звані прицільні відстані a-частинок від центрів атомів. Виявилося, що для золотої фольги для кутів розсіювання 150° прицільна відстань дорівнює 10-14 м. Якщо на такій відстані a-частинка й атом не взаємодіють, то це може означати лише одне ― розміри позитивно зарядженої частини атома не перевищують 10-15 м.
Ці дослідні факти дали можливість Резерфорду описати ядерну модель атома: в центрі атома міститься позитивно заряджене ядро атома, розміри якого мають величину порядку 10-15 м, навколо ядра по замкнутих орбітах в об’ємі сфери радіусом порядку 10-10 м обертаються електрони, причому їх кількість дорівнює порядковому номеру елемента.
В такому вигляді ядерна модель атома зберегла своє значення і до нашого часу, хоч і зазнала багатьох уточнень.
На кожний рухомий електрон в атомі діє доцентрова сила ядра, яка дорівнює кулонівській силі притягання електрона до ядра. Ця сила забезпечує стійкий орбітальний рух електрона в атомі, подібно орбітальному руху планет в сонячній системі.
Незважаючи на визначні успіхи в поясненні будови атома, які були досягнуті в рамках класичної планетарної моделі, ця теорія зіткнулася з рядом нездоланних суперечностей. Так, відповідно до законів класичної електродинаміки:
· заряджена частинка (електрон), що рухається з прискоренням (доцентровим), повинна постійно випромінювати електромагнетну енергію;
· частота цього випромінювання повинна дорівнювати частоті обертання електрона навколо ядра.
Отже, відповідно до цієї моделі, енергія атома повинна весь час зменшуватися, тоді як частота випромінювання весь час зростати. Оптичний спектр атома водню у цьому випадку має бути суцільним. Через дуже короткий проміжок часу (близько 10-11с) електрон мав би впасти на ядро, а атом припинити своє існування. Але атом є стійкою системою, а оптичний спектр атома водню дискретний (лінійчатий), а не суцільний.
Для усунення суперечностей планетарної моделі Н. Бор створив свою теорію водневоподібного атома, яка ґрунтується на таких постулатах:
1. Електрони, які рухаються в атомі на окремих стаціонарних рівнях, не випромінюють і не поглинають електромагнетних хвиль. У стаціонарних станах атома електрони рухаються уздовж колових орбіт, які мають дискретні значення моменту імпульсу
murn= n 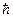 , (1.1.1)
, (1.1.1)
де m ― маса електрона; u ― лінійна швидкість орбітального руху; rn ― радіус n-ї колової орбіти; n ― порядковий номер стаціонарного рівня – головне квантове число; 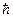 ― стала Планка поділена на 2p (
― стала Планка поділена на 2p ( 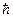 = h / 2p ).
= h / 2p ).
2. При переході електрона з однієї стаціонарної орбіти на іншу випромінюється або поглинається квант енергії
hn = En2 - En1 , (1.1.2)
який дорівнює різниці енергій двох стаціонарних рівнів атома.
Зміст формули (1.1.2) має принципове значення. Він виражає два нових фундаментальних твердження:
а) енергетичний спектр атома дискретний;
б) частоти атомного випромінювання пов’язані з атомними рівнями.
Величезна заслуга Нільса Бора перед наукою полягає у тому, що він уперше усвідомив дискретність енергетичного спектра атома. Історичний дослід Франка й Герца був першою перевіркою цих передбачень.
Теорія Бора також мала ряд внутрішніх суперечностей. З одного боку, в ній використовуються закони класичної фізики, а з іншого боку вона базується на квантових постулатах. Так результати теорії вивчення випромінювання атома водню і водневоподібних атомів блискуче збіглися з експериментом. Теорія Бора також пояснила причину випромінювання лінійчатих спектрів складними атомами, періодичний закон Менделєєва й закон Мозлі. Однак залишалось не з’ясованим: Чому рух електронів в атомах підпорядкований двом постулатам Бора? Чому одні лінії спектра досить інтенсивні, а інші ні? Чому здійснюються лише певні переходи електронів в атомах при випромінюванні й поглинанні ними енергії?
Досить значним недоліком теорії Бора була неможливість описати з її допомогою будову атома гелію, наступного за атомом водню елемента.
Відповіді на поставлені запитання дала квантова механіка, в якій на принципово новій основі установлені закономірності руху електронів в атомах і руху частинок в будь-яких інших системах.
Дата добавления: 2015-08-26; просмотров: 633;
