З урахуванням (1.1.12) і (1.1.13) одержимо
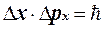 .(1.1.15)
.(1.1.15)
А оскільки не всі електрони формують центральний максимум, тому
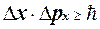 ,(1.1.16)
,(1.1.16)
де Dx іDpx ― похибки у визначені координати й імпульсу частинки; 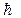 – стала Планка поділена на 2
– стала Планка поділена на 2 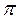 .
.
Співвідношення (1.1.16) можна узагальнити для всіх напрямків, тому:
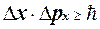 ,
,
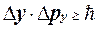 , (1.1.17)
, (1.1.17)
 .
.
Це і є співвідношення невизначеностей Гейзенберга.
Оскільки точні значення координати й імпульсу для мікрочастинки не існують, то про траєкторію частинки в мікросвіті можна говорити лише з певним наближенням. З цієї точки зору електрони в атомі не мають точних значень електронних орбіт.
У квантовій теорії використовується також співвідношення невизначеностей для енергії Е і часу t, тобто невизначеності цих параметрів задовольняють умову:
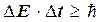 , (1.1.18)
, (1.1.18)
де DE ― похибка у визначенні енергії частинки;Dt―похибка у визна-ченні часу, коли частинка має енергію E.
Cпіввідношення невизначеностей неодноразово були предметом філософських дискусій. Однак вони не виражають собою певних обмежень пізнання мікросвіту, а лише указують межі використання у таких випадках понять класичної механіки.
Ще раз підкреслимо, що співвідношення невизначеностей не пов'язано з недосконалістю вимірювальної техніки, а є об'єктивною властивістю матерії: таких станів мікрочастинок, у яких і координата, і імпульс частинки мають визначене значення, просто не існує в природі.
Співвідношення невизначеностей допомагають зрозуміти багато особливостей поведінки мікрочастинок і дозволяють швидко й просто оцінити параметри їх стану. Для прикладу розглянемо застосування співвідношень невизначеностей до опису руху електрона в атомі водню.
Будемо вважати, що електрон локалізований в області простору, розміри якого дорівнюють розмірам атома. Тоді невизначеність координати електрона можна прийняти рівною радіусу атома: ∆ x = r. Звідси, відповідно до рівнянь (1.1.17), невизначеність значення імпульсу електрона ∆p =h / (2 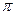 r). Очевидно, що значення самого імпульсу не може бути меншим його невизначеності, тому мінімально можливе значення імпульсу електрона дорівнює
r). Очевидно, що значення самого імпульсу не може бути меншим його невизначеності, тому мінімально можливе значення імпульсу електрона дорівнює
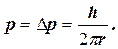 (1.1.19)
(1.1.19)
Рівняння (1.1.19) можна записати у вигляді p ∆ r = h/2π, або mvr = ћ. Цей результат – не що інше, як умова стаціонарної орбіти електрона в атомі водню відповідно до постулатів Н. Бора. Але, якщо Н. Бор увів свої постулати довільно, і тільки для атома водню, то ми одержали цю умову із загального універсального принципу – співвідношення невизначеностей.
Оцінимо енергію електрона в атомі водню. Енергія електрона складається з кінетичної енергії Ek = p2/2mі потенціальної енергії, що на відстані r від ядра дорівнює Ep= -e2/4  0r. Тоді повна енергія, з урахуванням рівняння (1.1.19), дорівнює
0r. Тоді повна енергія, з урахуванням рівняння (1.1.19), дорівнює
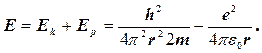 (1.1.20)
(1.1.20)
Залежність E(r) показана на графіку.

Як бачимо, залежність має мінімум при r=r0. Величину r0 легко знайти, узявши похідну від енергії E(1.1.20) по координаті r і прирів-нявши її до нуля:
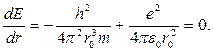
Звідси
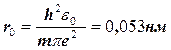
| (1.1.21) |
Ми одержали формулу й значення для радіуса першої “орбіти” електрона в атомі водню. Підставляючи значення r0 у рівняння(1.1.20), знаходимо вираз для мінімальної енергії електрона в атомі водню:
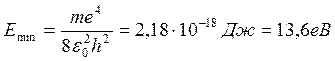 , ,
| (1.1.22) |
що збігається зі значенням енергії електрона на першій “орбіті” атома водню за теорією Бора. Отримані результати мають глибокий фізичний зміст. Відповідно до класичних уявлень, електрон буде мати мінімальну енергію, коли він упаде на ядро. Квантова механіка показує, що енергія електрона мінімальна, якщо він не “лежить на ядрі”, а рухається в межах сфери з радіусом r0 , при цьому його точне положення всередині даної сфери принципово не може бути визначено. При r<r0енергія електрона зростає.
Мінімальна енергія Emin, знайдена за допомогою співвідношення невизначеностей, збігається з мінімальним значенням енергії електрона в атомі водню за теорією Н. Бора. Однак ще раз підкреслимо, що наші результати отримані із загального, універсального принципу невизначеностей як окремий випадок, стосовно до атома водню, тоді як Н.Бор увів свої постулати винятково тільки для атома водню.
Звичайно, розглянута задача розв’язана приблизно, проте навіть таке наближене розв’язування пояснює, чому електрон не падає на ядро, і дозволяє правильно оцінити розміри атома і мінімальну енергію електрона.
Зупинимося на змісті, вкладеному в поняття “орбіта електрона” в атомі. На відміну від теорії Бора, у квантовій механіці не існує визначених орбіт електрона в атомі. Існування визначених орбіт, тобто точно відомих відстаней електрона від ядра, суперечить співвідношенню невизначеностей. Під терміном “орбіта електрона” у квантовій механіці розуміється відстань від ядра, на якій імовірність знайти електрон максимальна.
Дата добавления: 2015-08-26; просмотров: 730;
