Ідентифікація неорганічних аніонів і катіонів.
Описані в ДФУ загальні реакції на справжність можна розділити на три групи (в залежності від природи груп, що відкривають): визначення катіонів, аніонів та органічних функцій (див. таблицю 2). Як видно з таблиці, основне число реакцій на справжність складають реакції відкриття катіонів та аніонів. Деякі аніони (ацетат, тартрат та цитрат) відкриваються не тільки за допомогою іонних реакцій, але також і специфічними реакціями, не пов'язаними з їх іонною будовою. Як видно з Таблиці 2, загальні реакції на справжність дозволяють відкрити 10 катіонів, 17 аніонів.
Таблиця 2.Об’єкти загальних реакцій на справжність за ДФУ
| № | Катіон | № | Аніон |
| 1. | Амоній | 1. | Арсенат |
| 2. | Вісмут (ІІІ) | 2. | Арсеніт |
| 3. | Ферум (ІІІ) | 3. | Ацетат |
| 4. | Ферум (ІІ) | 4. | Бензоат |
| 5. | Калій | 5. | Бромід |
| 6. | Кальцій | 6. | Іодид |
| 7. | Магній | 7. | Гідрокарбонат |
| 8. | Натрій | 8. | Карбонат |
| 9. | Ртуть (ІІ) | 9. | Нітрат |
| 10. | Цинк | 10. | Нітрит |
| 11. | Саліцилат | ||
| 12. | Сульфат | ||
| 13. | Сульфіт | ||
| 14. | Тартрат | ||
| 15. | Фосфат | ||
| 16. | Хлорид | ||
| 17. | Цитрат |
Наведемо конкретні приклади реакцій ідентифікації:
Великою групою методів ідентифікації є методи, що ґрунтуються на утворенні осаду.
Реакції для ідентифікації іонів Na+ і K+:
реакція з винною кислотою
K+ + HOOC–(CHOH)2–COOH → HOOC–(CHOH)2–COOK↓+H+
винна кислота
або тетрафенілборатом натрію:
(C6H5)4BNa + K+ → (C6H5)4BK↓+Na+
тетрафенілборат білий
натрію осад
Справжність препаратів ртуті та деяких інших катіонів встановлюють за забарвленням сульфідів.
Hg2+ + S2– → HgS – чорний осад;
Zn2++ S2– → ZnS – білий осад;
2Bi3+ + 3S2– → Bi2S3 – коричнево-чорний осад;
2As3+ +3S2– → As2S3 – яскраво-жовтий осад.
Хлориди, броміди, йодиди визначають за реакцєю з нітратом срібла:
Ag++Cl–→ AgCl↓ - білий осад.
Розчини фосфатів при рН=7 дають з нітратом аргентуму жовтий осад:
PO43–+3Ag+→Ag3PO4↓
Ще однією групою реакцій, що застосовуються у фармацевтичному аналізі є окисно-відновні реакції, які використовують, наприклад, для визначення справжності препаратів , які містять Cu, Ag:
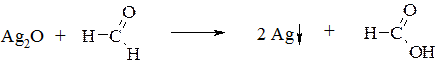
CuSO4+Fe(II) → Cu↓ + FeSO4
Окислювальні властивості галогенів використовують для ідентифікації бромідів, йодидів та виявлення вільного хлору:
Cl2 + 2I– → I2 + 2Cl–
далі йод ідентифікують йодкрахмальною реакцією.
Реакція окиснення дифеніламіну лежить в основі визначення нітратів і нітритів:
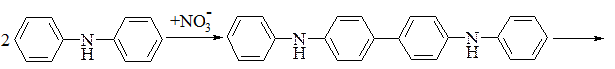
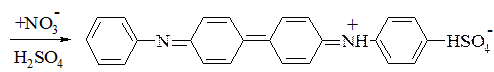
Використовуються також реакції розкладу аніонів:
Карбонати та гідрокарбонати під дією мінеральних кислот утворюють вуглекислий газ:
CO32–+ 2HCl → СО2↑ + H2O + 2Cl–
HCO3–+ HCl → СО2↑ + H2O + Cl–
Тіосульфати під дією розбавленої HCl дають дрібнодисперсний жовтий осад Сульфуру:
S2O32–+ 2HCl → SО2↑ + S↓ + H2O + 2Cl–
До методів ідентифікації аніонів і катіонів неорганічних сполук також можна віднести реакції, в результаті яких відбувається зміна забарвлення полум’я, утворюються зольні залишки при прожарюванні або нагріванні тощо.
Дата добавления: 2015-08-26; просмотров: 2034;
