Методы иммобилизации биообъектов.
Иммобилизация(immobili-satio; лат. immobilis — неподвижный)- ограничение подвижности молекул ферментов, позволяющие закрепить их активный центр, сохраняя максимальную работоспособность в течение длительного времени, не подвергаясь структурным изменениям.
Существует два основных метода иммобилизации ферментов: физический и химический.
Физическая иммобилизация ферментов представляет собой включение фермента в такую среду, в которой для него доступной является лишь ограниченная часть общего объема. При физической иммобилизации фермент не связан с носителем ковалентными связями. Существует четыре типа связывания ферментов:
- адсорбция на нерастворимых носителях;
- включение в поры геля;
- пространственное отделение фермента от остального объема реакционной системы с помощью полупроницаемой перегородки (мембраны);
- включение в двухфазную среду, где фермент растворим и может находиться только в одной из фаз.
Перечисленные подходы проиллюстрированы рисунке 3.
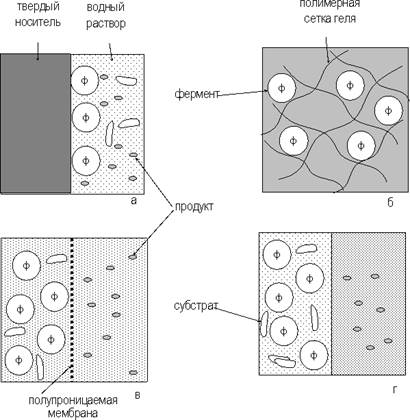
Рисунок 3. - Способы иммобилизации ферментов: а - адсорбция на нерастворимых носителях, б – включение в поры геля, в – отделение фермента с помощью полупроницаемой мембраны, г – использование двухфазной реакционной среды
Адсорбционная иммобилизация является наиболее старым из существующих способов иммобилизации ферментов, начало ей было положено еще в 1916 г. Этот способ достаточно прост и достигается при контакте водного раствора фермента с носителем. После отмывки неадсорбировавшегося белка иммобилизованный фермент готов к использованию. Удерживание адсорбированной молекулы фермента на поверхности носителя может обеспечиваться за счет неспецифических ван-дер-ваальсовых взаимодействий, водородных связей, электростатических и гидрофобных взаимодействий между носителем и поверхностными группами белка. Вклад каждого из типов связывания зависит от химической природы носителя и функциональных групп на поверхности молекулы фермента. Взаимодействия с носителем могут оказаться настолько сильными, что сорбция биокатализатора может сопровождаться разрушением его структуры. Например, при адсорбции некоторых растительных клеток на гранулах цитодекса клеточная стенка деформируется, повторяя рельеф поверхности частиц носителя. Преимуществом метода адсорбционной иммобилизации является доступность и дешевизна сорбентов, выступающих в роли носителей. Им также можно придать любую конфигурацию и обеспечить требуемую пористость. Важным фактор - простота применяемых методик. При адсорбционном связывании можно решить и проблему очистки фермента, так как связывание белка с носителем во многих случаях достаточно специфическое. К сожалению, прочность связывания фермента с носителем не всегда достаточно высока, что ограничивает применение метода. К недостаткам адсорбционной иммобилизации следует отнести отсутствие общих рекомендаций, позволяющих сделать правильный выбор носителя и оптимальных условий иммобилизации конкретного фермента.
Некоторых из перечисленных затруднений можно избежать при иммобилизации ферментов путем включения в гели. Суть этого метода иммобилизации состоит в том, что молекулы фермента включаются в трехмерную сетку из тесно переплетенных полимерных цепей, образующих гель. Среднее расстояние между соседними цепями в геле меньше размера молекулы включенного фермента, поэтому он не может покинуть полимерную матрицу и выйти в окружающий раствор, т.е. находится в иммобилизованном состоянии. Дополнительный вклад в удерживание фермента в сетке геля могут вносить также ионные и водородные связи между молекулой фермента и окружающими ее полимерными цепями. Пространство между полимерными цепями в геле заполнено водой, на долю которой обычно приходится значительная часть всего объема геля. Например, широко применяемые гели полимеров акриловой кислоты в зависимости от концентрации полимера и его природы содержат от 50 до 90% воды.
Для иммобилизации ферментов в геле существует два основных способа. При одном из них фермент помещают в водный раствор мономера, а затем проводят полимеризацию, в результате чего образуется полимерный гель с включенными в него молекулами фермента. В реакционную смесь часто добавляют также бифункциональные (содержащие в молекуле две двойные связи) сшивающие агенты, которые придают образующемуся полимеру структуру трехмерной сетки. В другом случае фермент вносят в раствор готового полимера, который затем каким-либо образом переводят в гелеобразное состояние. Способ иммобилизации ферментов путем включения в полимерный гель позволяет создавать препараты любой геометрической конфигурации, обеспечивая при этом равномерное распределение биокатализатора в объеме носителя. Метод универсален, применим для иммобилизации практически любых ферментов, полиферментных систем, клеточных фрагментов и клеток. Фермент, включенный в гель, стабилен, надежно защищен от инактивации вследствие бактериального заражения, так как крупные клетки бактерий не могут проникнуть в мелкопористую полимерную матрицу. В то же время, эта матрица может создавать значительные препятствия для диффузии субстрата к ферменту, снижая каталитическую эффективность иммобилизованного препарата, поэтому для высокомолекулярных субстратов данный метод иммобилизации не применим вообще.
Общий принцип иммобилизации ферментов с использованием мембран заключается в том, что водный раствор фермента отделяется от водного раствора субстрата полупроницаемой перегородкой. Полупроницаемая мембрана легко пропускает небольшие молекулы субстрата, но непреодолима для крупных молекул фермента. Существующие модификации этого метода различаются лишь способами получения полупроницаемой мембраны и ее природой. Водный раствор фермента можно включать внутрь микрокапсул, представляющих собой замкнутые сферические пузырьки с тонкой полимерной стенкой (микрокапсулирование). При двойном эмульгировании получается водная эмульсия из капель органического раствора полимера, содержащих, в свою очередь, еще более мелкие капли водного раствора фермента. Через некоторое время растворитель затвердевает, образуя сферические полимерные частицы с иммобилизованным в них ферментом. Если вместо водонерастворимого отвердевающего полимера используются жидкие углеводороды с высокой молекулярной массой, метод называется иммобилизацией путем включения в жидкие мембраны. К модификациям метода иммобилизации ферментов с использованием полупроницаемых оболочек относятся также включение в волокна ( при этом вместо капель, содержащих ферменты, получаются нити) и включение в липосомы. Применение систем мембранного типа позволяет получать иммобилизованные препараты с высоким содержанием фермента. Метод, как и предыдущий, достаточно универсален, т.е. применим как ферментам, так и к клеткам, а также их фрагментам. Благодаря высокому отношению поверхности к объему и малой толщине мембраны удается избежать значительных диффузионных ограничений скорости ферментативных реакций. Основной недостаток мембранных систем - невозможность ферментативного превращения высокомолекулярных субстратов.
При иммобилизации ферментов с использование систем двухфазного типа ограничение свободы перемещения фермента в объеме системы достигается благодаря его способности растворяться только в одной из фаз. Субстрат и продукт ферментативного превращения распределяются между обеими фазами в соответствии с их растворимостями в этих фазах. Природа фаз подбирается таким образом, что продукт накапливается в той из них, где фермент отсутствует. После завершения реакции эту фазу отделяют и извлекают из нее продукт, а фазу, содержащую фермент, вновь используют для проведения очередного процесса. Одним из важнейших преимуществ систем двухфазного типа является то, что они позволяют осуществлять ферментативные превращения макромолекулярных субстратов, которые невозможны при применении жестких носителей с ограниченным размером пор.
Главным отличительным признаком химических методов иммобилизации является то, что путем химического взаимодействия на структуру фермента в его молекуле создаются новые ковалентные связи, в частности между белком и носителем. Препараты иммобилизованных ферментов, полученные с применением химических методов, обладают по крайней мере двумя важными достоинствами. Во-первых, ковалентная связь фермента с носителем обеспечивает высокую прочность образующегося конъюгата. При широком варьировании таких условий, как рН и температура, фермент не десорбируется с носителя и не загрязняет целевых продуктов катализируемой им реакции. Это особенно важно при реализации процессов медицинского и пищевого назначения, а также для обеспечения устойчивых, воспроизводимых результатов в аналитических системах. Во-вторых, химическая модификация ферментов способна приводить к существенным изменениям их свойств, таких как субстратная специфичность, каталитическая активность и стабильность. Химическая иммобилизация ферментов является искусством, уровень которого определяется, в первую очередь, умением экспериментатора. Основная задача экспериментатора заключается в формировании новых ковалентных связей в молекуле фермента при использовании его функциональных групп, несущественных для проявления его каталитической активности. При химической модификации фермента его активный центр желательно защищать. При сопоставлении различных приемов иммобилизации химические методы для крупномасштабных биотехнологических процессов кажутся малопривлекательными из-за сложности и дороговизны. В промышленных процессах обычно используются те или иные методы физической иммобилизации.
Применение иммобилизованных ферментов.Особенно ощутимый вклад иммобилизованные ферменты внесли в тонкий органический синтез, в анализ, в медицину, в процессы конверсии энергии, в пищевую и фармацевтическую промышленности.
Для синтетической органической химии важно то, что в двухфазных реакционных средах фермент сохраняет каталитическую активность даже при исключительно малом содержании воды, поэтому равновесие катализируемой реакции (выход продукта) экспериментатор может регулировать в широких пределах, подбирая нужный органический растворитель. Иммобилизованные ферменты дали толчок к созданию принципиально новых методов "безреагентного" непрерывного анализа многокомпонентных систем органических (в ряде случаев и неорганических) соединений.
В будущем важную роль в контроле окружающей среды и в клинической диагностике должны сыграть такие методы, как биолюминесцентный анализ и иммуноферментный анализ.
В медицине иммобилизованные ферменты открыли путь к созданию лекарственных препаратов пролонгированного действия со сниженной токсичностью и аллергенностью. Иммобилизационные подходы способствуют решению проблемы направленного транспорта лекарств в организме.
Проблемы биоконверсии массы и энергии в настоящее время пытаются решить микробиологическим путем. Тем не менее иммобилизованные ферменты вносят ощутимый вклад в осуществление фотолиза воды и в биоэлектрокатализ.
Заслуживает внимание и использование иммобилизованных ферментов в процессах переработки лигноцеллюлозного сырья.
Иммобилизованные ферменты могут использоваться и как усилители слабых сигналов. На активный центр иммобилизованного фермента можно подействовать через носитель, подвергая последний ультразвуковой обработке, механическим нагрузкам или фотохимическим превращениям. Это позволяет регулировать каталитическую активность системы фермент - носитель под действием механических, ультразвуковых и световых сигналов. На этой основе были созданы механо- и звукочувствительные датчики и открыт путь к бессеребряной фотографии.
Промышленные процессы с применением иммобилизованных ферментов внедрены прежде всего в пищевую и фармацевтическую промышленность. В пищевой промышленности с участием иммобилизованных ферментов идут процессы получения глюкозо-фруктовых сиропов, глюкозы, яблочной и аспарагиновой кислоты, оптически активных L- аминокислот, диетического безлактозного молока, сахаров из молочной сыворотки и др.
В медицине иммобилизованные ферменты используются также как лекарственные препараты, особенно в тех случаях, когда необходимо локальное воздействие. Кроме того, биокатализаторы широко используются в различных аппаратах для перфузионной очистки различных биологических жидкостей. Возможности и перспективы использования в медицине ферментов в иммобилизованном состоянии гораздо шире, чем достигнутые на сегодняшний день, именно на этом пути медицину ждет создание новых высокоэффективных методов лечения.
Иммобилизованные клетки микроорганизмов.В 70-х годах XX века появились первые публикации об иммобилизации клеток микроорганизмов, а первое промышленное применение иммобилизованных клеток было осуществлено в Японии в 1974 г. С их помощью получали аспарагиновую кислоту.
Иммобилизованные клетки имеют ряд преимуществ, как перед иммобилизованными ферментами, так и перед свободными клетками:
- отсутствие затрат на выделение и очистку ферментов; - снижение затрат на выделение и очистку продуктов реакции;
- более высокая активность и стабильность;
- возможность создания непрерывных и полунепрерывных автоматизированных процессов;
- способность к длительному функционированию полиферментных систем без экзогенных кофакторов.
Для иммобилизации могут быть использованы клетки в различном состоянии: живые и поврежденные в различной степени. Одностадийные реакции могут осуществлять и живые, и поврежденные клетки. Полиферментные реакции проводят с применением живых клеток, которые могут длительное время регенерировать АТФ и коферменты (НАДФ, НАД).
Проблема использования ферментативной активности иммобилизованных микроорганизмов имеет глубокие корни. Более 150 лет назад быстрый способ получения уксуса был основан на применении микроорганизмов, адсорбированных на древесной стружке. Методы иммобилизации клеток схожи с методами иммобилизации ферментов.
Химический метод основан на образовании ковалентных связей с активированным носителем, на поперечной сшивке клеток за счет активных групп в клеточной оболочке с бифункциональными реагентами (например, глутаровым альдегидом)
К физическим методам относятся адсорбция и агрегация.
Иммобилизация клеток путем включения в различные гели, мембраны, волокна основана на химических и физических взаимодействиях. Химические методы используются реже по сравнению с другими методами и малопригодны для иммобилизации живых клеток. Гораздо большее распространение получило включение клеток в состав гелей, мембран и волокон. При таком способе иммобилизации клетки могут сохранять жизнеспособность и в присутствии питательной среды размножаться в приповерхностных слоях гелей. Биокаталитическая активность целых иммобилизованных клеток в настоящее время может быть использована в различных отраслях науки и техники:
- при биосинтезе и трансформации таких соединений, как аминокислоты, органические кислоты, антибиотики, стероиды углеводы, углеводороды, нуклеотиды и нуклеозиды;
- в пивоварении и виноделии;
- при очистке сточных и природных вод;
- при извлечении металлов из сточных вод; - при ассимиляции солнечной энергии;
- при изготовлении водородных солнечных элементов; - в азотфиксации;
- в аналитических целях при изготовлении электродов.
Наибольшее количество исследований по иммобилизации клеток микроорганизмов проведено японскими исследователями. Особые успехи были достигнуты ими в области синтеза аминокислот, органических кислот и антибиотиков. В Московском государственном университете был разработан метод получения аспарагиновой кислоты, который по эфективности не уступает японским. Клетки E.coli, включенные в армированный полиакриламидный гель, были с успехом использованы для получения аспарагиновой кислоты, период полужизни катализатора - 110 суток. Иммобилизовать можно не только клетки микроорганизмов, но и клетки растительных и животных тканей, используя их для синтеза физиологически активных соединений.
Интересные возможность открываются и при иммобилизации клеточных органелл как активных полиферментных систем. Все это свидетельствует о перспективности развития одного из направлений биотехнологии, связанного с изучением и применением иммобилизованных клеток.
Применение ферментов. Ферменты в течение многих лет применяются в различных областях практической деятельности человека: в кожевенной, пищевой, текстильной, фармацевтической и других отраслях промышленности, а также в медицине, сельском хозяйстве, химическом синтезе.
Новые возможности в применении ферментов открылись перед прикладной энзимологией в связи с созданием иммобилизованных ферментов. Иммобилизация означает взаимодействие ферментов или их активных фрагментов с растворимыми или нерастворимыми носителями, в результате чего происходит ограничение движения ферментов в пространстве.
Для получения иммобилизованных ферментов используют многочисленные носители различной природы. Носители должны быть устойчивы к воздействию химических и биологических факторов, иметь высокую проницаемость для ферментов и субстратов, а также легко переходить в активированное состояние.
Органические полимерные носители разделяют на природные и синтетические. К природным носителям относятся полисахариды, белки и липиды. Наиболее часто для иммобилизации на основе полисахаридов используют агарозу, целлюлозу, хитин, декстран и их производные.
К синтетическим полимерным носителям относятся полимеры на основе стирола, производные акриловой кислоты, а также полиамидные носители.
Ферменты находят разнообразное применение в различных отраслях промышленности и в медицине, например: в медицине – в качестве противовоспалительных, тромболитических, фибринолитических препаратов; в химии – в качестве катализаторов при проведении различных технологических процессов; в фармации – при анализе лекарственных веществ белковой природы; в промышленности – в качестве активных компонентов стиральных и моющих средств, в дубильных процессах, в пищевых производствах, например при обработке мяса.
Спектр применения различных ферментов в медицинской практике из года в год расширяется. Весьма эффективно использование гидролитических ферментов при болезнях желудочно- кишечного тракта, в качестве заместителей энзимотерапии (например, химотрипсина, трипсина, пепсина, амилазы и липазы). Чаще всего эти ферменты применяют в виде смесей, обладающих комбинированным действием (фестал, панзинорм и др.).
Аппликационное применение ферментов при лечении гнойных ран и трофических язв давно вошло в медицинскую практику. Чаще всего в этих случаях применяют протеолитические ферменты (трипсин, химотрипсин). При многих заболеваниях сосудов, таких, как артериальный тромбоз и глубокий тромбофлебит, с успехом применяют протеолитические ферменты различного происхождения.
Особое место занимает энзимотерапия опухолевых заболеваний. Так, L- аспарагиназу уже в течение многих лет применяют для лечения некоторых форм лейкоза.
В медицинской практике в качестве лекарственных средств широко применяются ингибиторы ферментов. К ним относятся тканевые ингибиторы протеиназ, такие, как трасилол, инипрол, кантрикал. Эти ингибиторы, способные ингибировать широкий круг протеолитических ферментов, находят применение при таких заболеваниях, как панкреатит, энфизема легких, инфаркт миокарда и др.
Об эффективности и надежности диагностики с использованием ферментативных тестов можно судить по их чувствительности и специфичности. Чувствительность теста определяется достоверным отличием ферментативной активности в норме и при заболевании. Появление в крови большого количества α-амилазы или липазы свидетельствует о наличии острого панкреатита, а лактатдегидрогеназы – инфаркта миокарда. Увеличение в сыворотке крови активности кислой фосфатазы однозначно указывает на наличие рака предстательной железы, а повышенное содержание церулоплазмина связано с наследственной патологией – гепатолентикуляторной дегенерацией.
В фармации первостепенное значение имеет стандартизация и контроль качества лекарственных препаратов. В ряде случаев, применительно к лекарственным веществам природного происхождения, используют стандартизацию, основанную на биологической активности соответствующего вещества. Стандартизация и контроль качества ферментов – лекарственных препаратов также оценивают по их каталитической активности.
Многие ферменты используют в пищевой промышленности. В кондитерском производстве применяется инвертаза дрожжей, превращающая сахарозу в глюкозу и фруктозу, предотвращая кристаллизацию сахарозы при высоких её концентрациях.
Глюкозоизомераза, иммомилизованная на целлюлозном носителе, применяется для получения глюкозо- фруктозных сиропов с преимущественным содержанием фруктозы. Крупномасштабным производством является получение глюкозы из крахмала.
Для просветления пива используют протеиназы, в частности папаин, иммобилизованный на хитине. В пивоварении для замены солода используют амилазы. В хлебопечении амилазы на 30% ускоряют процесс созревания теста, улучшают качество хлеба, предотвращая процесс черствения.
Ферменты используют в нескольких технологических процессах при обработке молока. При производстве сыра одной из основных стадий является коагуляция молока, которая осуществляется при помощи ренина.
Целлюлазы используют при приготовлении растворимого кофе, при обработке цитрусовых.
В кожевенном производстве для обработки шкур применяют препараты протеиназ микробного происхождения, при этом качество сырья значительно улучшается, а время технологического процесса сокращается почти в два раза.
В текстильной промышленности пектолитические ферменты с успехом используют для переработки льносоломы и получения из неё льноволокна. Некоторые протеиназы применяют для обесклеивания шелка и высвобождения шелковых волокон.
Широкое применение нашли ферменты в тонком органическом синтезе. Чаще всего используют гидролитические ферменты, иммобилизованные на растворимых носителях. В частности, гидролазы применяют для модификации пенициллинов и цефалоспоринов.
Выделение, очистка и иммобилизация ферментов являются трудоёмким и дорогостоящим процессом. Однако во многих случаях цель оправдывает средства, и иммобилизованные ферменты все больше находят применение в биотехнологии.
Производство ферментов. Получение ферментов с помощью микроорганизмов более выгодно, чем из растительных и животных источников. Микробные клетки продуцируют более 2 тысяч ферментов, катализирующих биохимические реакции, связанные с ростом, дыханием и образованием продуктов. Многие из этих ферментов могут быть выделены и проявляют свою активность независимо от клетки.
В мире производится около 20 ферментов в объеме 65 тыс. тонн (а существует, как предполагают 25000 ферментов). Например, промышленным способом производят такие ферменты как амилаза, глюкоамилаза, протеаза, инвертаза, пектиназа, каталаза, стрептокиназа, целлюлаза и др.
Амилазы и протеазы используют в текстильной, хлебопекарной и кожевенной промышленности. Пектолитические ферменты могут быть использованы для мацерации тканей при переработке растительного сырья, например при получении льноволокна. Щелочные протеазы, особенно иммобилизованные, очень эффективно используются в составе моющих средств. Кроме протеолитических ферментов в состав моющих средств вводят липазу, целлюлазу, оксидазу и амилазу для удаления загрязнений крахмального происхождения. Использование иммобилизованной глюкозоизомеразы для непрерывного получения глюкозы является наиболее крупным процессом такого рода в мире.
Микробные ферменты активно используют в клинической диагностике при определении уровня холестерина в крови и мочевой кислоты. Ферменты предлагают использовать для очистки канализационных и водопроводных труб и т.д. и т.п. Ферменты для медицинских или аналитических целей должны быть высокоочищенными.
Для повышения стабильности выделенных ферментов используют технику иммобилизации, т.е. связывания ферментов на поверхности нерастворимого в воде носителя, например, органических полимеров, стекла, минеральных солей, силикатов и т.п. Иммобилизованные ферменты (ИФ) можно длительное время использовать в биохимических реакторах в условиях непрерывного процесса.
Примеры использования ИФ - изомеризация глюкозы во фруктозу, гидролиз белков, трансформация стероидов, гормонов и т.д. Новая область применения ИФ - создание на их основе бессеребряных фотоматериалов. На основе действия ферментов построены биолюминесцентные и иммуноферментные методы анализа, отличительной чертой которых является высокая чувствительность и абсолютная специфичность.
Технология ферментных препаратов. Основную часть ферментов, получаемых промышленным способом, составляют гидролазы. К ним относятся, в первую очередь амилолитические ферменты: α-амилаза, β-амилаза, глюкоамилаза. Их основная функция - гидролиз крахмала и гликогена. Крахмал при гидролизе расщепляется на декстрины, а затем до глюкозы. Эти ферменты применяются в спиртовой промышленности, хлебопечении.
Протеолитические ферменты образуют класс пептидгидролаз. Их действие заключается в ускорении гидролиза пептидных связей в белках и пептидах. Важная их особенность - селективный характер действия на пептидные связи в белковой молекуле. Например, пепсин действует только на связь с ароматическими аминокислотами, трипсин - на связь между аргинином и лизином. В промышленности протеолитические ферменты классифицируют по способности проявлять активность в определенной области рН: - рН 1.5 - 3.7 - кислые протеазы; - рН 6.5 - 7.5 - протеазы; - pH > 8.0 - щелочные протеазы. Протеазы находят широчайшее применение в разных отраслях промышленности:
- мясная - для смягчения мяса;
- кожевенная - смягчение шкур;
- кинопроизводство - растворение желатинового слоя при регенерации пленок;
- парфюмерная - добавки в зубную пасту, кремы, лосьоны;
- производство моющих средств - добавки для удаления загрязнений белковой природы;
- медицина - при лечении воспалительных процессов, тромбозов и т.д.
Пектолитические ферменты уменьшают молекулярную массу и снижают вязкость пектиновых веществ. Пектиназы делятся на две группы - гидролазы и трансэлиминазы. Гидралазы отщепляют метильные остатки или разрывают гликозидные связи. Трансэлиминазы ускоряют негидролитическое расщепление пектиновых веществ с образованием двойных связей. Применяются в текстильной промышленности (вымачивание льна перед переработкой), в виноделии - осветление вин, а также при консервировании фруктовых соков.
Целлюлолитические ферменты очень специфичны, их действие проявляется в деполимеризации молекул целлюлозы. Обычно используются в виде комплекса, доводящего гидролиз целлюлозы до глюкозы (в гидролизной промышленности). В медицинской промышленности их используют для выделения стероидов из растений, в пищевой - для улучшения качества растительных масел, в сельском хозяйстве - как добавки в комбикорма для жвачных животных.
Существует ряд факторов, влияющих на биосинтез ферментов. В первую очередь, к ним относится генетический. Состав и количество синтезируемых ферментов наследственно детерминированы. Применяя мутагены можно изменить генетические свойства микроорганизмов и получить штаммы с ценными для промышленности свойствами. К мутагенным факторам относятся ионизирующее и неионизирующее излучения, изотопы, антибиотики, другие химические соединения, преобразующие наследственные элементы клетки. Несмотря на определяющую роль генетического фактора в биосинтезе ферментов, производительность биотехнологических процессов зависит и от состава питательной среды. При этом важно не только наличие источников основных питательных веществ, но и веществ, играющих роль индукторов или репрессоров биосинтеза данного конкретного фермента или их групп. Механизм этого явления еще не вполне изучен, но сам факт должен учитываться при выборе технологии.
Рассмотрим несколько примеров. Фермент липаза почти не синтезируется грибом Asp.awamori на среде без индуктора, добавление жира кашалота усиливает биосинтез фермента в сотни раз. При добавлении же в среду крахмала и при полном исключении минерального фосфора интенсивно синтезируется фосфатаза. Не только наличие индуктора способно увеличивать выход фермента. Важную роль играет состав питательной среды и условия культивирования. При разработке процесса биосинтеза a-амилазы культурой Asp.oryzae замена сахарозы (как источника углерода) на крахмал увеличила активность фермента в 3 раза, добавление солодового экстракта (из проросших семян злаковых) ещё в 10 раз, а повышение концентрации основных элементов питательной среды на 50% - ещё в 2 раза.
Для интенсификации процесса роста и синтеза ферментов добавляют различные факторы роста, например, аминокислоты, пуриновые основания и их производные, РНК и продукты её гидролиза. В качестве источника углерода используют крахмал, кукурузный экстракт, соевую муку, гидролизаты биомассы дрожжей. Микроорганизмы могут утилизировать и минеральные источники азота. В состав питательных сред входят и ионы MG, Mn, Zn, Fe, Cu и др. металлов. Механизм действия большинства из них неизвестен. Некоторые входят в состав фермента. Ионы Ca повышают устойчивость a-амилазы, ионы Fe и Mg активизируют и стабилизируют протеолитические ферменты.
Оптимальный состав питательной среды для каждого продуцента может быть определен двумя способами: эмпирический и построение математической модели с использованием компьютера. Последний, естественно, предпочтительнее. По характеру культивирования все технологические процессы производства ферментных препаратов делятся на две большие группы: глубинный и поверхностный методы.
Глубинный метод культивирования продуцентов ферментов.
В этом случае микроорганизмы выращиваются в жидкой питательной среде. Технически более совершенен, чем поверхностный, так как легко поддается автоматизации и механизации. Концентрация фермента в среде при глубинном культивировании обычно значительно ниже, чем в водных экстрактах поверхностной культуры. Это вызывает необходимость предварительного концентрирования фильтрата перед его выделением.
При глубинном культивировании продуцентов ферментов выделяют, как и в любом биотехнологическом процессе, 5 этапов.
1. Приготовление питательных сред зависит от состава компонентов. Некоторые предварительно измельчают, отваривают или гидролитически расщепляют. Готовые к растворению компоненты подают при постоянном помешивании в емкость для приготовления среды в определенной последовательности. Стерилизацию среды проводят либо путем микрофильтрации с помощью полупроницаемых мембран, либо при помощи высоких температур. Время обработки в этом случае зависит как от интенсивности фактора, так и от уровня обсемененности объекта. Стерилизуются также все коммуникации и аппараты. Воздух очищается до и после аэрирования. До - потому что содержит частицы пыли органической и неорганической природы, после - так как несет клетки продуцента.
2. Получение засевного материала. Для засева питательной среды материал готовят также глубинным методом. Вид его зависит от продуцента: для грибов это мицелиальная вегетативная масса, для бактерий - молодая растущая культура на начальной стадии спорообразования. Получение посевного материала состоит в увеличении массы продуцента в 3-4 стадии. Объем посевного материала зависит от физиологических особенностей продуцента. Если продуцент размножается только вегетативно, он резко возрастает (до 5-20%). Если же происходит обильное спороношение - сокращается до 1%.
3. Производственное культивирование. Биосинтез ферментов в глубинной культуре протекает в течение 2-4 суток при непрерывной подаче воздуха и перемешивании. Высокая концентрация питательных веществ на первых этапах могут тормозить рост биомассы продуцента, поэтому часто свежая среда или некоторые её компоненты вводятся в ферментер на стадии активного роста. Температурный оптимум находится в интервале 22-32оС. В современных технологических процессах ведется непрерывное автоматическое определение содержания в среде углеводов, количества образовавшихся метаболитов и концентрации клеток. Данные поступают в ЭВМ, которая определяет стратегию коррекции процесса и автоматически регулирует его. Этим достигается максимальная производительность и наилучшее качество продуктов.
4. Выделение. В мицелии трёхсуточной культуры обычно остается не более 15% ферментов. Остальные выделяются в окружающую клетки жидкую среду. В этом случае препараты ферментов выделяют из фильтратов после отделения биомассы.
5. Получение товарной формы.
Поверхностный метод культивирования продуцентов ферментов
При поверхностном методе культура растет на поверхности твердой увлажненной питательной среды. Мицелий полностью обволакивает и довольно прочно скрепляет твердые частицы субстрата, из которого получают питательные вещества. Поскольку для дыхания клетки используют кислород, то среда должна быть рыхлой, а слой культуры-продуцента небольшим.
Выращивание производственной культуры происходит обычно в асептических условиях, но среду и кюветы необходимо простерилизовать. Перед каждой новой загрузкой также необходима стерилизация оборудования.
Преимущества поверхностной культуры: значительно более высокая конечная концентрация фермента на единицу массу среды (при осахаривании крахмала 5 кг поверхностной культуры заменяют 100 кг культуральной жидкости), поверхностная культура относительно легко высушивается, легко переводится в товарную форму.
Посевной материал может быть трёх видов:
- культура, выросшая на твердой питательной среде;
- споровый материал;
- мицелиальная культура, выращенная глубинным способом.
В три этапа получают и посевную культуру. Сначала музейную культуру продуцента пересевают на 1 - 1.5 г увлажненных стерильных пшеничных отрубей в пробирку и выращивают в термостате до обильного спорообразования. Второй этап - аналогично, но в колбах, третий - в сосудах с 500 г среды.
Основу питательной среды составляют пшеничные отруби, как источник необходимых питательных и ростовых веществ. Кроме того, они создают необходимую структуру среды. Для повышения активности ферментов к отрубям можно добавлять свекловичный жом, соевый шрот, крахмал, растительные отходы. Стерилизуют среду острым паром при помешивании (температура - 105-140 С, время 60-90 минут). После этого среду засевают и раскладывают ровным слоем в стерильных кюветах. Кюветы помещают в растильные камеры. Культивируют в течение 36-48 часов.
Рост делится на три периода, примерно равных по времени. Сначала происходит набухание конидий и их прорастание (температура не ниже 28о С), затем рост мицелия в виде пушка серовато-белого цвета (необходимо выводить выделяемое тепло) и образование конидий. Для создания благоприятных условий роста и развития продуцента необходима аэрация и поддержание оптимальной влажности (55-70%).
Выросшая в неподвижном слое при поверхностном культивировании культура представляет корж из набухших частиц среды, плотно связанных сросшимся мицелием. Массу размельчают до гранул 5-5 мм. Культуру высушивают до 10-12% влажности при температурах не выше 40оС, не долее 30 минут. Иногда препарат применяют прямо в неочищенном виде - в кожевенной и спиртовой промышленности. В пищевой и особенно медицинской промышленности используются ферменты только высокой степени очистки.
Схема очистки сводится к следующему:
- освобождение от нерастворимых веществ;
- освобождение от сопутствующих растворимых веществ;
- фракционирование (как правило, хроматографическими методами).
Для выделения фермента из поверхностной культуры необходима экстракция. Как правило, экстраген - вода. При этом в раствор переходят сахара, продукты гидролиза пектиновых веществ и целлюлозы. Стадию выделения и очистки завершает сушка. После сушки препарат должен содержать не более 6-8% влаги, тогда он может в герметичной упаковке храниться до года без потери активности.
Стандартизация ферментного препарата - доводка активности фермента до стандартной, соответствующей требованиям ГОСТ. Для этого используются различные нейтральные наполнители - крахмал, лактоза и др.
Учитывая огромные перспективы применения ферментных препаратов в различных отраслях промышленности и сельского хозяйства, медицине, можно сделать заключение о необходимости расширения исследований в этой области для оптимизации технологии и гарантийного получения высокоактивных и стабильных препаратов микробных ферментов.
Литература.
1.В.П. Комов, В.Н. Шведова, Биохимия: учеб. для вузов –М.:Дрофа, 2004.- 638 с.
2.Кретович В.Л.Основы биохимии растений.- М.:Высшая школа, 1986.
3.Ленинджер А.(в трех томах) – М.:Мир, 1985.
4. Уайт А., Хендлер Ф. Основы биохимии (в трех томах).- М.: Мир, 1981.
5. Кнорре Д.Г. Мызина С.Д. Биологическая химия. – М.: Высшая школа, 2002.
6.Розанцев Э.Г. Прикладная биохимия и прикладная биотехнология. – М.: Изд-во МГУ,1998.
7.Биотехнология. Принципы и применение /Хиггинс И., Бест Д., Джонс Дж. М.: Мир, 1988. 480 с.
8. Быков В.А., Манаков М.Н., Панфилов В.И. и др. Производство белковых веществ. М.: Высшая школа, 1987. 142 с.
9.Грачева И.М., Гаврилова Н.М., Иванова Л.А. Технология микробных белковых препаратов, аминокислот и жиров. М.: Пищевая промышленность, 1980. 448 с.
10. Егоров Н.С. Основы учения об антибиотиках. М.: Высшая школа, 1986. 448 с.
11.Казанская Н.Ф., Ларионова Н.И., Торчилин В.П. Ферменты и белковые препараты в медицине // Биотехнология. М.: Наука, 1984
Контрольные вопросы к главе 6.
1. Перечислите инновационные медицинские технологии.
2. Укажите значение иммобилизованных ферментов.
Литература:
1. Бирюков В.В. Основы промышленной биотехнологии. – М.: КолосС, 2004. – 296 с.
2. Биотехнология. В 8 кн. / Под редакцией Н.С. Егорова, В.Д. Самуилова. – М.: Высшая школа, 1987 г.
3. Воробьева Л.И. Техническая микробиология. – Изд. МГУ, 1987.
4. Грачева И.М., Иванова Л.А., Кантере В.М. Технология микробных белковых препаратов, аминокислот и биоэнергия. – М.: "Колос", 1992.
5. Грачева И.М., Кривова А.Ю. Технология ферментных препаратов. – М.: Изд-во "Элевар", 2000 – 512 с.
6. Грачева И.М., Гаврилова Н.Н., Иванова Л.А. Технология микробных белковых препаратов, аминокислот и жиров. – М.: "Пищевая промышленность", 1980.
7. Горбунова В.Н., Баранов В.С. (1997) Введение в молекулярную диагностика и генотерапию наследственных заболеваний, Специальная литература, СПб.
8. Дж. Бейли, Д.Оллис. Основы биохимической инженерии (в 2-х томах). – М.: Мир, 1989.
9. Зеленин В.А., ред. (2000) Генотерапия - Медицине Будущего. Сборник статей, "Геном человека", М.
10. Елинов Н.П. Основы биотехнологии. – Изд-во "Наука", Сиб. отделение, 1995.
11. Егоров Н.С. Основы учения об антибиотиках. – М.: Высшая школа, 1990.
12. Интернет-журнал «Коммерческая биотехнология» http://www.cbio.ru/ по материалам BIO.org.
13. Кузьмина Н. А. Основы биотехнологии. Электронный учебник. - http://www.biotechnolog.ru/map.htm
14. Куликов А.В., Жданов Р.И. (2000) Вопр. биол. мед. фарм. химии, № 1, 24-29.
15. Калунянц К.А., Голгер Л.И. Микробные ферментные препараты. – М.: "Пищевая промышленность", 1979.
16. Мосичев М.С., Складнев А.А., Котов В.Б. Общая технология микробиологических производств. – М.: "Пищевая промышленность", 1982.
17. Промышленная микробиология. / Под ред. Н.С. Егорова). – М.: Высшая школа, 1989.
18. Производство антибиотиков. / Под ред. С.М. Навашина. – М.: "Медицина", 1970.
19. Ферментация и технология ферментов. (Уонг Д., Косней И., Демайн А. и др.). Пер. с англ. – М.: " Пищевая промышленность", 1983.
Дата добавления: 2015-07-14; просмотров: 12891;
