Физико-химические основы ионного обмена
Обработка воды методом ионного обмена
Методы ионного обмена принципиально отличаются от методов осаждения тем, что удаляемые из воды примеси не образуют осадка, и тем, что такая обработка не требует непрерывного дозирования реагентов. Эксплуатация ионитных фильтров значительно проще, габариты аппаратов меньше, а эффект очистки выше.
Сущность ионного обмена заключается в использовании способности специальных материалов, называемых ионообменными материалами или ионитами, изменять в желаемом направлении ионный состав воды.
Способность ионитов к ионному обмену объясняется их специфической структурой. Ионит состоит из твердой нерастворимой в воде молекулярной сетки, к отдельным местам которой на поверхности и внутри ее массы присоединены химически активные функциональные группы атомов ионита. С электрохимической точки зрения каждая молекула является своеобразным твердым электролитом. В результате электролитической диссоциации ионита вокруг нерастворимого в воде ядра образуется ионная атмосфера, представляющая собой ограниченное пространство вокруг молекулы ионита, в котором находятся подвижные и способные к обмену ионы. Если эти подвижные ионы имеют положительный заряд, ионит называется катионитом, если отрицательный - анионитом.
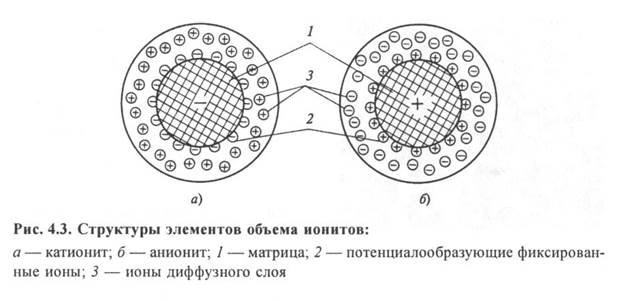
Реакции ионного обмена подчиняются правилам, действующим для реакции обычных электролитов:эквивалентность обмена ионов, обратимость этого процесса, селективность.
Эквивалентность заключается в том, что обмен ионов между раствором и ионитом происходит в эквивалентных соотношениях так, чтобы соблюдался принцип электронейтральности раствора. Однако следует отметить, что суммарное количество ионов в растворе может меняться после ионирования вследствие протекания вторичных реакций (нейтрализации, образования малодиссоциируемых соединений). Если вода щелочная, то выделяющийся водород вступает во взаимодействие с ионами ОН – и образует малодиссоциируемое соединение – воду, при этом количество ионов в растворе уменьшается.
Обратимость процесса позволяет экономно использовать ионит в технологических схемах. Преимущественное направление реакции обмена определяется согласно закону действующих веществ. При истощении ионита можно, повысив в растворе концентрацию первоначальных обменных
ионов, сдвинуть реакцию ионного обмена в направлении восстановления
ионита в исходное состояние, т.е. произвести регенерацию ионита.
Способность ионита к преимущественной сорбции одних видов ионов перед другими называется селективностью. Причиной, вызывающей селективность, является различие энергий притяжения различных ионов твердой фазой, обусловленной значениями радиусов сорбируемых ионов и их зарядов. При увеличении заряда иона (т.е. при повышении его валентности) увеличивается энергия притяжения его по закону Кулона противоположно заряженной твердой фазой. Поэтому с повышением валентности ионов селективность их сорбции ионитом возрастает. Соответственно: двухвалентные ионы сорбируются лучше чем одновалентные, а трехвалентные поглощаются лучше двухвалентных.
Установлены ряды селективности для катионов и анионов, в которых каждый последующий ион сорбируется лучше, чем предыдущий. Например, для сильнокислотного катионита КУ-2 получен следующий ряд: H+<Na+<NH4+<Mg2+<Zn2+<Cu2+<Ca2+<Al3+…
Основные катионы природных вод могут быть выделены в следующий ряд селективности:
H+<Na+<Mg2+<Ca2+.
Для ионов высокоосновного анионита действует следующий ряд:
ОН – <HSiO3 – <HCO3 – < Cl – <H2PO4 – <NO3 – < SO42 –.
Основные анионы природных вод характеризуются следующим рядом селективности:
Дата добавления: 2015-08-26; просмотров: 3547;
