Водород-катионирование.
При Н-катионировании обменными ионами являются катионы водорода. В процессе фильтрования из воды поглощаются все содержащиеся в ней катионы согласно ряду селективности, то есть Са2+, Mg2+, Na+ и другие, а в воду переходит эквивалентное количество Н+ ионов. Кроме того, происходит разрушение ионами водорода бикарбонатной щелочности воды с образованием свободной углекислоты. Протекают следующие реакции:
2HR + Ca(HCO3)2 Û CaR2 + 2H2O + 2CO2;
2HR + Mg(HCO3)2 Û MgR2 + 2H2O + 2CO2;
2HR + CaCl2 Û CaR2 + 2HCl;
2HR + MgSO4 Û MgR2 + H2SO4;
HR + NaCl Û NaR + HCl;
2HR + Na2SO4 Û 2NaR + H2SO4.
В результате этих реакций общая жесткость снижается до 0,01 мг-экв/кг, а карбонатная жесткость [Са(НСО3)2 и Mg(НСО3)2] полностью удаляется, вследствие чего происходит устранение щелочности воды и снижение солесодержания. В процессе Н-катионирования все катионы заменяются катионами водорода Н+, а присутствующие в исходной воде соли: сульфаты, хлориды и нитраты кальция, натрия и другие, преобразуются в свободные кислоты: серную, соляную, азотную, кремниевую… Общая
кислотность фильтрата равна сумме содержащихся в воде анионов минеральных кислот SO42–, Cl–, NO3– и др. Н-катионированная вода является кислой, непригодной для питания паровых котлов, поэтому этот метод всегда сочетают с Na- катионированием или анионированием, что дает возможность нейтрализовать кислотность и снизить щелочность обработанной воды.
Вследствие селективности удержания ионов катионитом, весь слой условно можно разбить на зоны по поглощаемым катионам. Ближе к нижней границе слоя располагается зона поглощения ионов Na+, над ней - смешанная зона поглощения Mg2+ и Na+, а еще выше - зона поглощения Са2+, Mg2+. Суммарная высота этих зон определяет величину рабочей зоны катионита. Над ней располагается слой истощенного катионита, а под ней - свежего.
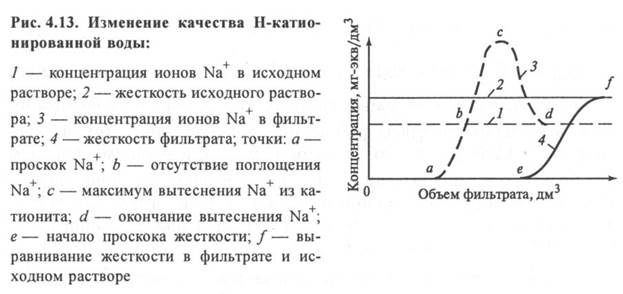
При работе Н-катионитного фильтра наблюдаются два периода. В первом происходит полное поглощение всех катионов до момента достижения зоной поглощения ионов Na+ нижней границы слоя катионита (работа до проскока Na+). В этот период кислотность фильтрата остается постоянной. Второй период начинается с проскока ионов Na+ в воду. С этого момента содержание Na+ в обработанной воде начинает возрастать, так как этот ион не может полностью улавливаться катионитом, пока не достигнет концентрации Na+ как в исходной воде. К этому моменту Н-катионит совсем прекращает поглощать Na+ из обрабатываемой воды и происходит только улавливание ионов Са2+ и Mg2+. Эти ионы Са2+ и Mg2+. наряду с обменом на ионы Н+ начинают вытеснять ранее поглощенные ионы Na+ из катионита, поэтому содержание Na+ в фильтрате становится больше его концентрации в исходной воде. Происходят одновременно процессы водород- и натрий-катионирования с постепенным переходом в Na-катионирование, так как ионы Н+ в катионите уже полностью заменены на ионы Na+, Са2+, Mg2+(точка О). Содержание натрия в фильтрате снижается по мере истощения катионита и возвращается к его концентрации в исходной воде по мере приближения проскока ионов жесткости Мg2+ (точка Р). Во втором периоде снижается кислотность фильтрата и начинает возрастать щелочность. При переходе в режим Na-катионирования щелочность восстанавливается полностью.
При умягчении воды Н-катионитные фильтры отключаются на регенерацию по проскоку ионов жесткости Са2+ и Mg2+ в фильтрат, а при химическом обессоливании - по проскоку катионов Na+, то есть при снижении кислотности фильтрата.
Эффект умягчения воды при Н-катионировании обычно столь же полный, как и при Na-катионировании. Он зависит от качества регенерации ионита, его природы и состава исходной воды. Регенерация производится 1...1,5 % раствором серной кислоты, как более дешевой и удобной по сравнению с соляной. Последняя также может применяться для регенерации (например, для вод с высоким содержанием Na+). Реакции регенерации описываются следующими уравнениями:
СаR2 + H2SO4 Û 2HR + CaSO4;
MgR2 + H2SO4 Û 2HR + MgSO4;
2NaR + H2SO4 Û 2HR + Na2SO4.
При регенерации катионита соляной кислотой продуктами регенерации являются хлориды кальция, магния, натрия, хорошо растворимые в воде. При использовании серной кислоты один из продуктов регенерации сульфат кальция (СаSO4) обладает ограниченной растворимостью и способен «загипсовывать» катионит. Это обстоятельство заставляет ограничивать крепость регенерационного раствора до 1...1,5 % или осуществлять ступенчатую регенерацию: сначала 1% раствором Н2SO4, а затем, когда основная масса Са2+ и Mg2+ вытеснена и опасности гипсования уже нет, более крепким 5...6 % раствором кислоты для более полного вытеснения поглощенных катионитом ионов. Скорость пропуска регенерационного раствора выбирают также исходя из условий предотвращения кристаллизации гипса, а не диффузии при обмене ионов, как при Na-катионировании. Для сокращения времени контакта раствора кислоты с катионитом скорость фильтрования принимают 10...15 м/ч. По этой же причине, а также во избежание усиления коррозии оборудования, не допускается повышение температуры обрабатываемой воды и регенерационного раствора.
Кислотность Н-катионированной воды, то есть концентрация в ней противоиона Н+, определяется разностью между суммой всех анионов и щелочностью воды и зависит от суммарной концентрации хлоридов и сульфатов. Противоионный эффект заметно проявляется в Н-катионированной воде, которая содержит значительное количество ионов SO 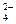 и Cl-. Чем больше некарбонатная жесткость, тем ниже рН фильтрата, тем сильнее противоионный эффект. В этом случае сильно подавляется диссоциация особенно слабокислотного катионита и уменьшается рабочая обменная емкость Н-катионита. Обменная емкость и эффект умягчения воды зависят лишь от концентрации нейтральных солей, так как бикарбонаты кальция, магния и натрия не повышают концентрацию противоиона в фильтрате. Чем больше противоионный эффект, тем больший требуется удельный расход кислоты на регенерацию для достижения заданной остаточной жесткости фильтрата. Существенно снижается расход реагента при применении противоточной регенерации или двухступенчатого Н-катионирования.
и Cl-. Чем больше некарбонатная жесткость, тем ниже рН фильтрата, тем сильнее противоионный эффект. В этом случае сильно подавляется диссоциация особенно слабокислотного катионита и уменьшается рабочая обменная емкость Н-катионита. Обменная емкость и эффект умягчения воды зависят лишь от концентрации нейтральных солей, так как бикарбонаты кальция, магния и натрия не повышают концентрацию противоиона в фильтрате. Чем больше противоионный эффект, тем больший требуется удельный расход кислоты на регенерацию для достижения заданной остаточной жесткости фильтрата. Существенно снижается расход реагента при применении противоточной регенерации или двухступенчатого Н-катионирования.
Иногда применяется «голодная регенерация» Н-катионитных фильтров. В этом случае при катионировании происходит не глубокое умягчение исходной воды, а разрушение её карбонатной щелочности без образования кислого фильтрата. Это достигается тем, что фильтры регенерируются таким количеством кислоты, которого недостаточно для вытеснения всех катионов, ранее поглощенных из воды. Это приводит к расположению в верхних частях фильтрующего слоя обменного иона Н+ водорода (отрегенерированный слой), а в нижних слоях- обменных катионов кальция и магния. В слоях, находящихся в Н+-форме протекают реакции обмена улавливаемых из воды ионов на ионы водорода, который переходит в воду с образованием сильных кислот и угольной кислоты. В ниже расположенных слоях ионы водорода сильных кислот обмениваются на ионы кальция, магния, натрия. Слабая угольная кислота, диссоциация которой подавлена в присутствии сильных кислот, значительную часть слоя проходит «транзитом» и обменивает некоторое количество ионов водорода уже в нижних слоях, обусловливая появление щелочности. С течением времени количество обменных ионов Н+ уменьшается и одновременно происходит их перемещение из вышележащих слоев в нижележащие. К моменту окончания рабочего цикла все количество введенных при регенерации ионов  + оказывается израсходованным на разрушение щелочности исходной воды. В момент повышения щелочности фильтр выводится на регенерацию. Прошедшая через такой слой вода не содержит сильных кислот и имеет незначительную щелочность (Щ=0,2-0,3 мг-экв/кг).
+ оказывается израсходованным на разрушение щелочности исходной воды. В момент повышения щелочности фильтр выводится на регенерацию. Прошедшая через такой слой вода не содержит сильных кислот и имеет незначительную щелочность (Щ=0,2-0,3 мг-экв/кг).
Режим «голодной регенерации» отличается от других режимов регенерации с недостатком кислоты тем, что на протяжении всего рабочего цикла обеспечивается нулевая кислотность фильтрата и минимальная щелочность. Любые другие модификации регенерации с недостатком кислоты не обеспечивают этого требования.
Такой режим применяется в схемах подготовки подпиточной воды для тепловых сетей.
Дата добавления: 2015-08-26; просмотров: 3195;
