Гаплоидная технология
1 Микроспоры (незрелая пыльца) in vitro ведут себя по-разному. Единицы из них переходят с гаметофитного пути развития на спорофитный и формируют эмбриоид. Другие дедифференцируются и образуют каллус. Часть из них может продолжать микроспорогенез и гаметогенез, а какая-то часть вообще деградирует и погибает. Н. Сандерланд исследовал первые этапы развития изолированных микроспор дурмана в культуре и показал, что они отличаются от нормального развития микроспор (рис. 10). Микроспора in vitro может разделиться на две «равные» клетки (путь развития Б), то есть не происходит дифференцирующего деления с образованием вегетативной и генеративной клетки.
Такой переход с гаметофитного на сапрофитный путь развития характерен для Datura innoxia, Nicotiana tabacum.
Одноядерная микроспора в результате первого неравного деления образует вегетативную и генеративную клетки (путь развития А). Генеративная клетка после первого митотического деления дегенерирует и все последующее развитие микроспоры идет по зиготическому пути через многократное деление вегетативной клетки (А-В путь). Этот путь развития наблюдается у Nicotiana tabacum, Datura metel, Hordeum vulgare, Triticum aestivum и др. В других случаях может делиться только генеративная клетка (А-Г путь). Возможно, что обе клетки (вегетативная и генеративная) делятся и участвуют в образовании спорофита (А-ГВ путь). Описанные пути развития микроспоры in vitro приводят к образованию гаплоидной многоклеточной структуры, из которой в дальнейшем сформируется гаплоидное растение-регенерант.
В случае же слияния вегетативного ядра с генеративным (путь Ц), спорофит, развившийся из диплоидной клетки , будет диплоидным.
Кроме того, диплоиды могут возникать из нередуцированных микроспор, которые имели аномалии в развити (нарушения в мейозе), а также в результате эндополиплоидии на последующих стадиях формирования спорофита. Трудно сказать, что является индуктором переключения программы развития микроспоры с гаметофитного на спорофитный путь, участвуют в этом процессе нормальные или аномальные микроспоры. Поведение микроспор определяется многими факторами, в том числе их естественным полиморфизмом, причиной которого могут быть аномалии в развитии, позиционное положение веретена деления в спорах.
Процесс перехода микроспор с гаметофитного на спорофитный путь развития определяется на генетическом уровне, но реализуется в зависимости от конкретных физиологических условий и различных по действию индуцирующих факторов. Направление развития микроспор прежде всего определяется стадией, на которой были изолированы пыльники, а также гормональным составом питательной среды.
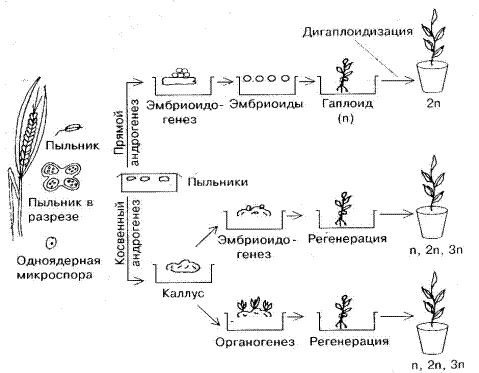
Образовавшаяся из микроспоры многоклеточная структура далее может развиться в каллусную ткань. Образование гаплоидных растений из эмбриоидов называется прямым андрогенезом, из каллуса – косвенным (рис.11).
Из тысяч микроспор, содержащихся в пыльнике, только из единиц развиваются эмбриоиды. Возможно, способность к эмбриоидогенезу генетически обусловлена. Экспериментально установлено увеличение частоты эмбриогенных микроспор под действием стрессовых воздействий, например, низких и высоких температур, ионизирующих излучений. Для прямого андрогенеза имеет значение физиологическое состояние донора, стадия развития пыльцы в момент введения пыльника в культуру, состав питательной среды и условия культивирования. Для многих растений наиболее благоприятной стадией развития является одноядерная микроспора.
Не все растения, регенерировавшие из каллусов, являются гаплоидными, поэтому для массового получения гаплоидов стараются индуцировать пыльцевой эмбриоидогенез.

Рисунок 10. Схема развития микроспоры по спорофитному пути с образованием эмбриоидов или каллусной ткани
В.Ананд с сотрудниками, культивируя пыльники одного из сортов виргинского табака Nicotiana tabacum, наблюдали образование эмбриоидов трех типов: путем деления вегетативной клетки, генеративной и обеих клеток.
|
Рисунок 10
|
Из этих эмбриоидов они получили растения и выращивали их далее в почве до цветения. Морфологический анализ листьев и цветков показал, что эти растения также подразделялись на три типа. Установлено, что в культуре пыльников и микроспор образуется два типа каллусов: каллусы, содержащие неорганизованную массу гетерогенных клеток, и каллусы, состоящие частично из меристематических клеток. Процесс регенерации связан со вторым типом каллусов, у которых образование побегов происходит из меристематических очагов путем последующей дифференциации.
Были проведены различные эксперименты, свидетельствующие о том, что начальные этапы морфогенеза зависят от положения исходных микроспор в археспорангии. Регенерация растений происходила как из эмбриоидов, так и путем органогенеза из морфогенных каллусов, которые образовывались как из первичного каллуса, так и в результате дедифференциации глобул и эмбриоидов.
Развитие микроспор пшеницы in vitro осуществлено Б. Б. Анапияевым в КазНУ им. аль-Фараби. Установлена возможность прямого эмбриоидогенеза в культуре изолированных пыльников и микроспор пшеницы. В развитии андроклинных структур (эмбриоиды и каллусы) выявлены критические периоды: а) первый митоз и последующие, формирование многоклеточного комплекса; б) стадия глобулы; в) стадия проэмбрио. На критических этапах своего развития эмбриоиды могут дедифференцироваться в каллус, в этом случае регенерация растений происходит через вторичный эмбриоидогенез или органогенез (геммогенез, гемморизогенез).
2 Получение андрогенных гаплоидов in vitro сопряжено со многими трудностями из-за слабой теоретической изученности проблемы. Мы не знаем, как идет регуляция морфофизиологических процессов внутренними и внешними факторами на разных стадиях развития микроспоры, какие нужны условия для реализации тотипотентности микроспор и т.д. Это заставляет исследователей действовать эмпирически, подбирая оптимальные условия и корректируя их для разных видов и сортов растений.
Продуктивность андрогенеза in vitro зависит от многих взаимосвязанных факторов: генотипа донорного растения, условий его выращивания, стадии развития микроспор, предобработки эксплантов, состава питательных сред, режима культивирования и др.
Одним из основных факторов, лимитирующих андрогенез in vitro, является генотип донорного растения. Причем не только внутри рода, но и сорта одних и тех же видов обнаруживают различную способность к регенерации растений. Например, пыльники сортов риса японского подвида намного более продуктивны, чем пыльники индийского подвида. В исследованиях И.С. Рахимбаева с сотрудниками в КазГУ при испытании 27 генотипов ячменя и 24 генотипов пшеницы андрогенетическая способность в культуре пыльников варьировала на разных питательных средах в пределах соответственно от 0 до 31,6 и от 0 до 14,7 %.
Результаты многих исследований показывают, что взаимосвязь между генотипом и морфогенезом in vitro является сложной, особенно это касается однодольных растений. И. Васил считает, что физиологическое состояние экспланта на момент изолирования оказывает большое влияние на его морфогенетические способности, чем генотип. Оптимизация условий культивирования с учетом физиологического состояния экспланта может снизить влияние генотипа на андрогенез in vitro. Как подтверждение этой предпосылки выступают установленные факты о влиянии на эффективность андрогенеза in vitro условий выращивания донорных растений. Так, например, регенерация растений идет лучше в культуре пыльников, выделенных из растений, выращенных в поле, чем в теплице. По-видимому, это результат комплексного влияния факторов внешней среды.
Оптимальные условия выращивания доноров различаются для каждого вида растения. Имеются примеры положительного влияния на частоту индукции каллусов и эмбриоидов из микроспор действия различных физических и химических факторов на растения-доноры (низкие и высокие температуры, недостаток азота в питании, лазерная обработка и др.). Среди этих факторов особо значимым является температурный. Холодовая предобработка растений-доноров, колосьев, пыльников способствует сохранению жизнеспособности пыльцы и увеличивает частоту образования эмбриоидов. Вместе с тем не существует стандартных рекомендаций по режиму предобработки. Температура и продолжительность обработки зависят от вида, стадии развития пыльцы, временем ее сбора. Однако, в литературе встречаются факты отрицательного воздействия низких температур на андрогенез. Иногда положительный эффект дают инкубация пыльников при повышенной температуре, например 30 оС для рапса, или последовательная холодовая и высокотемпературная их обработка, в частности для горчицы.
Решающую роль для индукции андрогенеза in vitro играет стадия развития микроспор в момент их изоляции для культивирования. В зависимости от вида растений наиболее благоприятны стадии между концом мейоза и поздней двуядерной стадией. При переносе пыльников в культуру на оптимальной стадии развития наблюдаются преимущественный пыльцевой эмбриогенез и формирование растений.
У различных растений установлено существование определенной фракции микроспор, способных к эмбриоидогенезу in vitro, так называемых Р-зерен. Они существуют in vivo и отличаются от других типов микроспор меньшими размерами, отсутствием крахмала, светлой цитоплазмой, иногда дополнительными митозами, вследствие чего могут быть многоядерными. Это явление получило название пыльцевого диморфизма.
Питательная среда и условия культивирования имеют большое значение для эффективности андрогенеза in vitro. Чаще всего используют основные среды Мурасиге и Скуга, Гамборга, агаризованные или жидкие. На жидкой среде каллусогенез из микроспор идет быстрее и лучше, но эффективность регенерации растений ниже, поэтому чаще применяют поверхностное культивирование пыльников.
В зависимости от вида питательной среды (твердая, жидкая) и площади ее поверхности зависит плотность посадки пыльников. Так, при культивировании пыльников ячменя в жидкой среде в чашках Петри в каждом миллилитре среды должно быть не менее 60 пыльников. Плотность посадки пыльников на твердую среду в пробирках – 18-20 штук, в чашках Петри диаметром 40-60 мм – 60-80 штук.
Содержание сахарозы в среде варьируется в зависимости от вида растения от 2 до 12 %.
В зависимости от вида растений и стадии развития микроспоры варьируется гормональный состав среды.
Дата добавления: 2015-07-14; просмотров: 3924;