Условия окисления марганца
Марганец - элемент легкоокисляющийся, особенно при сравнительно невысоких температурах; при этом могут образовываться следующие оксиды марганца: MnO2, Mn2O3, Mn3O4, MnO. При высоких температурах устойчивой является только закись марганца MnO.
Рассмотрим схемы реакций окисления марганца:
1. Расходуется кислород газовой фазы
[Mn] + 1/2{O2} = (MnO). (7.1‑14)
Тепловой эффект DQ составляет 362 кДж/моль.
2. Кислород, растворенный в металле
[Mn] + [O] = (MnO), DQ = 162 кДж/моль. (7.1‑15)
3. Кислород шлака
[Mn] + (FeO) = (MnO) + [Fe], DQ = 121 кДж/моль . (7.1‑16)
Также как и в реакциях окисления кремния, реакции окисления марганца характеризуются значительным тепловым эффектом. Продукт реакции - шлакообразующий оксид. Основное место протекания реакции – граница раздела металл-шлак, поэтому марганец преимущественно окисляется по схеме (7.1-16). Для этой реакции
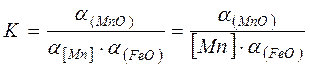 , (7.1‑17)
, (7.1‑17)
откуда
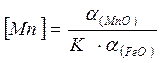 . (7.1‑18)
. (7.1‑18)
Таким образом, полнота окисления марганца в сталеплавильных процессах зависит от температуры и состава шлака.
Зависимость от температуры представлена уравнением (7.1-11). Величина теплового эффекта реакций окисления марганца DQ >> 0, следовательно, с понижением температуры (¯Т) константа реакции возрастает (К), что приводит к понижению содержания марганца в металле (¯[Mn]). С ростом температуры константа уменьшается, следовательно, возможен процесс восстановления марганца при определенном составе шлака.
Дата добавления: 2015-06-22; просмотров: 876;
