Условия окисления кремния
Кремний - элемент легко окисляющийся. В зависимости от источника кислорода окисление кремния представлено:
1. Кислородом газовой фазы
[Si] + {O2} = (SiO2), DQ = 775 кДж/моль, (7.1‑6)
где DQ - количество выделяемого тепла при окислении.
2. Кислородом, растворенным в металле
[Si] + [O2] = (SiO2), DQ = 542 кДж/моль. (7.1‑7)
Кислородом шлаковой фазы
[Si] + 2(FeO) = (SiO2) + 2[Fe], DQ = 300 кДж/моль. (7.1‑8)
Во всех случаях при окислении кремния выделяется значительное количество тепла. Окисление кремния может протекать интенсивно во всем интервале температур сталеварения при наличии окислителя. Продукт реакции (SiO2) переходит шлак.
Роль реакции определяется местом протекания. Реакция (7.1-6) протекает в начальный момент окисления. Реакция (7.1-7) затруднена, т.к. она связана с появлением новой фазы. Поэтому основной является реакция (7.1-8). Для этой реакции константа равновесия рассчитывается по формуле
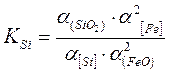 , (7.1‑9)
, (7.1‑9)
где a[Fe], a(SiO2), a[Si], a(FeO) - активности [Fe], (SiO2), [Si], (FeO) cоответственно.
Оценим активности:
1. a[Fe] ®1, т.к. концентрация железа стремится к 1.
2. a[Si] = [Si].
3. a(SiO2) = (SiO2)св, a(FeO) = (FeO)св, согласно молекулярной теории.
Подставим значения активностей в уравнение (7.1-9) и определим содержание кремния в металле
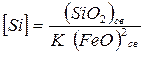 . (7.1‑10)
. (7.1‑10)
Это выражение можно применять для определения условий окисления кремния. Реакция проходит тем полнее, чем меньше равновесная концентрация кремния в металле. Полнота протекания реакции зависит от константы равновесия и концентрации, то есть от температуры и состава.
Зависимость от температуры определяется по формуле
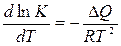 , (7.1‑11)
, (7.1‑11)
где DQ - тепловой эффект реакции; R - универсальная газовая постоянная, К – константа равновесия, Т – температура.
При уменьшении температуры, константа равновесия возрастает, следовательно, содержание кремния в металле [Si] уменьшается, то есть реакция протекает полнее.
При возрастании температуры константа уменьшается и [Si] снижается. Этот случай характеризует обратимость реакции окисления кремния.
Влияние состава шлака определяется:
1. Содержанием свободных оксидов кремния. При постоянном содержании (SiO2), концентрация свободных оксидов кремния снижается с ростом основности шлака по следующим реакциям:
(SiO2) + (CaO) = (CaO×SiO2), (7.1‑12)
(SiO2) + 2(CaO) = (2CaO×SiO2). (7.1‑13)
При этом возрастает полнота протекания реакций, то есть реакция окисления кремния (7.1-8) протекает полнее, чем выше основность шлака.
2. Влиянием (FeO). Чем больше содержание (FeO), тем меньше равновесная концентрация [Si], то есть повышение окислительной способности шлаков увеличивает полноту окисления кремния.
В общем случае влияние состава шлака можно представить в виде диаграммы (рис. 7.1-2).
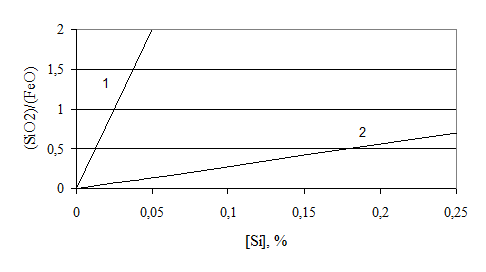
 |
В основных реакциях окисление кремния протекает необратимо (восстановление невозможно). В кислых процессах может реализовываться процесс восстановления кремния, т.к. в кислых шлаках (SiO2) не связано в химические соединения.
Дата добавления: 2015-06-22; просмотров: 1305;
