Удаление серы (десульфурация)
Влияние серы на свойства стали можно установить из диаграммы состояния Fe-S. Сера в виде FeS неограниченно растворима в жидком железе. Но при d-g - превращениях растворимость снижается до 0,06 %, в зоне аустенитного состояния до 0,005 %. Избыточная по отношению к g-Fe сера вытесняется в жидкую фазу, которая располагается по границам зерен аустенита. Кристаллизация жидкой фазы, обогащенной серой заканчивается при t = 988 оС.
При нагреве металла до 1200 оС (перед прокаткой или ковкой) границы зерен аустенита находятся в жидком состоянии и при пластической деформации слиток покрывается трещинами и дефектами. Потеря пластичности металла в области высоких температур называется красноломкостью.
Основным виновником красноломкости является сера, поэтому ее содержание в металле ограничивается: в стали обычного качества [S] до 0,045 %; в стали особо высокого качества менее 0,015%. Но это не исключает явления красноломкости. Вопрос стоит в том, чтобы снизить содержание серы в стали ниже 0,005%.
Влияние серы усугубляется высокой ликвационной способностью, которая примерно в три раза выше, чем у фосфора. Учитывая неравномерное распределение серы по слитку нужно получить заведомо меньшее ее содержание в стали (S < 0,01-0,015 %).
Десульфурация в сталеплавильных процессах основана на переводе серы из металла в шлак. Сера в виде FeS неограниченно растворима как в металле, так и в шлаке. Поэтому распределение серы между металлом и шлаком подчиняется закону распределения Нернста-Шилова: компоненты, растворимые в двух соприкасающихся жидких фазах, распределяются между ними таким образом, что в состоянии равновесия (при постоянной температуре) отношение активности компонента в одной фазе к активности компонента в другой фазе – величина постоянная
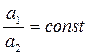 . (7.1‑29)
. (7.1‑29)
Для бесконечно разбавленных растворов соотношение (7.1-29) можно записать как постоянство отношений концентраций компонентов С1/С2 = const.
Коэффициент десульфурации определяется по формуле
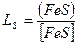 , (7.1‑30)
, (7.1‑30)
т.к. LS величина постоянная, то для уменьшения [FeS] нужно снизить концентрацию (FeS). Для удаления серы из металла в шлак, необходимо перевести серу в химическое соединение, которое растворяется в шлаке, но не растворяется в металле. К таким соединениям относятся CaS, MgS, MnS и др. Можно также увеличить количество шлака, но этот способ экономически не выгоден.
Десульфурацию представляют в две стадии:
1. Процесс установления равновесия FeS в металле и шлаке
[FeS] = (FeS). (7.1‑31)
Перевод (FeS) в (СаS)
(FeS) + (CaO) = (CaS) + (FeO). (7.1‑32)
В сумме реакции дают
[FeS] +(CaO) = (CaS) + (FeO), (7.1‑33)
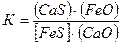 . (7.1‑34)
. (7.1‑34)
Из соотношений (7.1-34) и (7.1-30) можно установить, что
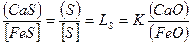 . (7.1‑35)
. (7.1‑35)
Соотношение (7.1-35) позволяет определить влияние состава шлака на процесс десульфурации. Чем выше LS, тем больше завершенность процесса.
Условия роста LS:
1. Увеличение основности шлака ( СаО).
2. Снижение окислительной способности шлака (¯ FeO).
Второе условие трудновыполнимо, т.к. все сталеплавильные процессы окислительные, т.е. образуется большое количество (FeO).
Рассмотрим влияние температуры на процесс десульфурации. Реакция (7.1-33) эндотермическая, протекает с поглощением тепла (с t оС, К), следовательно, повышение температуры положительно сказывается на процесс десульфурации.
Поэтому для десульфурации стали стремятся использовать те периоды плавки, в которые металл максимально нагрет, при высокой температуре ванны энергично окисляется углерод, получает развитие реакция [СО] + (FeO) = {CO} + [Fe] и активность (FeO) уменьшается, улучшается перемешивание металла.
Дата добавления: 2015-06-22; просмотров: 970;
