Скелетные мышцы
Структурно-функциональной единицей скелетной мышцы является мышечное волокно – многоядерная клетка, образовавшаяся из мезодермы слиянием нескольких сотен, а иногда и тысяч клеток. Длина мышечного волокна достигает 100-1000мкм., толщина 20-80 мкм Покрыто мышечное волокно двухслойной мембраной – сарколеммой. Непосредственно к цитоплазме прилежит плазмалемма – обычная плазматическая мембрана толщиной 7,5нм. Через некоторое пространство, заполненное соединительно-тканными волокнами, располагается базальная мембрана (5,5нм), которая является общей для пучка из 20-40 мышечных волокн.
Основное внутриклеточное пространство мышечного волокна заполнено миофибриллами диаметром 1-2 мкм. Их около 2000 и они тянутся вдоль всего мышечного волокна и сформированы в саркомеры.
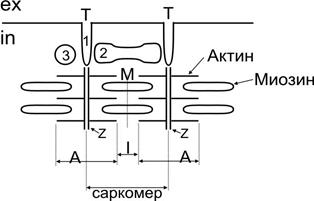
Саркомер скелетных мышц. Особенностью скелетной, как и всех поперечно-полосатых мышц, является поперечная исчерченность внутреннего содержимого цитоплазмы характерными структурами саркомерами (Рис.).
|
Длина саркомера (от Z- до Z-пластины) в скелетных мышцах составляет 2,2мкм. В этих структурах располагаются основные сократительные белки актин и миозин. Строгая упорядоченность их в саркомерах приводит с чередованию оптически более плотных и менее плотных структур.
К Z-пластинам саркомера симметрично по обе стороны прикрепляются нити актина. Между ними в оптически менее плотной (изотропной) зоне I-дисков расположены нити миозина. Посредине каждого I-диска имеется М-полоса – особая мембрана, на которой фиксируются нити миозина. Частично нити актина и миозина перекрываются, образуя оптически более плотную (анизотропную) зону или А-диск. Светлую часть А-диска Н-полосу, содержащую только нити актина, посредине пересекает Z-пластина.
Триада скелетных мышц представляет собой совокупность структур, обеспечивающих запуск сокращения в ответ на раздражение сарколеммы. Она образована тремя структурами (см.Рис):
1. Т-системой – впячивания плазматической мембраны внутрь мышщечного волокна диаметром около 0,03 мкм.
2. Концевыми цистернами саркоплазматического ретикулума (СПР).
3. Продольными каналами СПР.
Обычно триада распалагаются вблизи Z-пластин саркомера.
Структура и функция сократительных белков
Основную сократительную функцию во всех видах мышц осуществляют тонкие и толстые нити-миофиламенты (миофибриллы) актин и миозин.
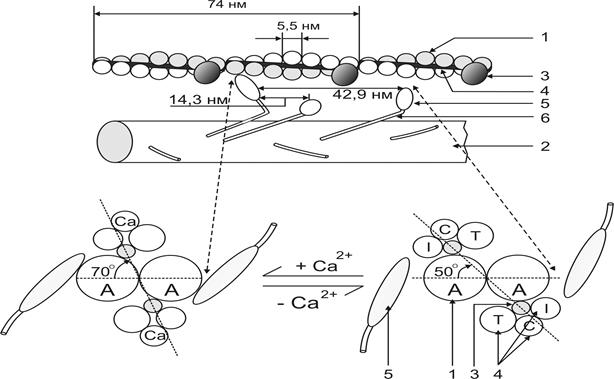
Вспомогательную-регуляторную осуществляют тропомиозин (TrM, ММ:68 кD) и комплекс тропонина (Tr, ММ:70 кD), который состоит из субединиц (Рис.)
|
1. Ингибиторный тропонин- TrI, ММ:21 kD;
2. Тропонинсвязывающий тропонин-TrT ММ:31 kD;
3. Кальций-связывающий тропонин –TrC, ММ:18 kD.
Молекула актина встречается в двух формах: глобулярной (G) и фибриллярной (F). Переход из G- в F-форму происходит в присутствии АТФ и ионов кальция непосредственно перед сокращением. G-форма представляет собой глобулу ММ 48 кD. Полимеризованная F-форма собирается на тропомиозине вместе с тропониновым комплексом: на одной молекуле TrM+ Tr(I,T,C) обнаруживается 7 G-глобул актина. Кроме того, в окончательном варианте две таких структуры закручиваются относительно друг друга, образуя суперспираль –миофибриллу актина, непосредственного участника сокращения.
Молекула миозина (ММ:480 кD) состоит из 2-х тяжелых (2x200 кD) и 4-х легких цепей. Две из них (18,5 кD) –отщепляются при обработке миозина 5,5-дитиобис-2-нитрбензойной кислотой (ДТНБ цепи). Две другие (20,7 кD и 16,5 kD) диссоциируют в щелочной среде и названы щелочными. Легкие цепи формируют головку молекулы миозина, обладающей способностью к АТФ-азной активности (щелочные цепи) и изменению конформации под воздействием ионов кальция (ДТНБ-цепи). Толстая миофибрила содержит около сотни молекул миозина, закрученных относительно друг друга тяжелыми цепями от центра к краям. В результате, центральная область толстых нитей миозина не содержит головок легких цепей, обладающих АТФ-азной активностью.
Дата добавления: 2015-06-22; просмотров: 1840;
