Закон Стокса: спектр люминесценции сдвинут в длинноволновую область относительно спектра поглощения того же соединения.
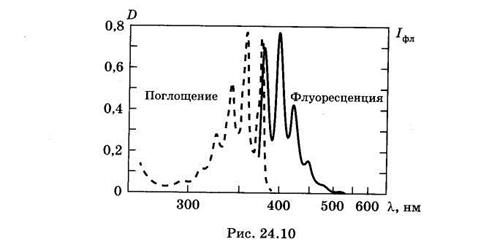
На рис. 24.10приведены спектры поглощения и флуоресценции антрацена. Причина сдвига спектров заключается в том, что электронный переход при поглощении происходит с нижнего колебательного уровня основного состояния на любые колебательные уровни возбужденных электронных уровней (рис. 23.16).При этом часть энергии возбуждения молекул переходит в тепло (направленные вниз волнистые стрелки), и они оказываются на нижнем колебательном уровне нижнего возбужденного электронного состояния. Излучение происходит только с такого уровня на любые колебательные подуровни основного состояния. Длина стрелок, изображающих поглощательные и излучательные переходы в молекуле, пропорциональна энергии поглощенных или излученных фотонов. Из рис. 23.16 видно, что энергия поглощенных квантов выше, чем излученных (направленные вниз прямые стрелки короче, чем направленные вверх) — это отражает превращение части энергии возбужденного состояния молекулы в тепловую энергию окружающих молекул:
Из рис. 23.16 видно, что энергия поглощенных квантов выше, чем излученных (направленные вниз прямые стрелки короче, чем направленные вверх) — это отражает превращение части энергии возбужденного состояния молекулы в тепловую энергию окружающих молекул.
Форма спектра люминесценции (правило Каши) и квантовый выход люминесценции (закон Вавилова) не зависят от длины волны возбуждения люминесценции.Причина этого в том, что излучение люминесценции происходит всегда с нижнего колебательного уровня нижнего возбужденного электронного состояния, независимо от того, на какой уровень молекула была возбуждена после поглощения. Спектр фотолюминесценции по форме совпадает со спектрами других типов люминесценции данного вида молекул, т. е. форма спектра люминесценции не зависит от способа возбуждения молекулы.
Спектральное положение полосы флуоресценции (как и длинноволновой полосы поглощения) зависит от длины системы сопряженных двойных связей l: чем больше l, тем большей длине волны соответствует максимум флуоресценции lmах. Кроме того, на положение lmах (а также на квантовый выход) флуоресценции некоторых молекул могут сильно влиять свойства окружающей среды. Так, например, для диметиламинохалкона в гептане (диэлектрическая проницаемость гептана e = 1,9) lmах = 436 нм, а в воде (e = 81) lmах = 560 нм. Чувствительность параметров флуоресценции молекул к особенностям среды (диэлектрической проницаемости, вязкости и др.), в которой они оказались, используется в биологии и медицине.
Если флуоресцирующие молекулы вводятся в исследуемую систему как индивидуальные вещества, которые затем сами в соответствии со своими свойствами распределяются в ней, то такие молекулы называют флуоресцентными зондами. Примером применения флуоресцентных зондов может служить внутривенное введение пациентам флуоресцеина. Этот краситель не токсичен, обладает очень высоким квантовым выходом флуоресценции (около 90%). Он с током крови разносится по всему организму и диффундирует в дерму и эпидермис. Флуоресцеин возбуждают невидимым глазом ближним УФ-светом (365 нм) и наблюдают его зеленую флуоресценцию. По скорости появления флуоресценции в поверхностных тканях судят об участках тела с пониженным кровообращением, в них флуоресцеин появляется позже, чем в участках тела с нормальным кровообращением.
В других случаях флуоресцирующие красители ковалентно связывают с какими-либо молекулами и затем вводят их в исследуемую систему. Такие молекулы называют флуоресцентными метками. Примером может служить использование флуоресцентно-меченых антител. Если добавить такие антитела к суспензии смеси клеток, то они связываются только с теми из них, на поверхности которых находятся специфические к данному антителу антигены. Возникает яркая флуоресценция определенных клонов клеток, хорошо видная в люминесцентных микроскопах, в которых в отличие от обычных источников света, как правило, используют ртутные лампы высокого и сверхвысокого давлений и применяют два светофильтра. Один из них, расположенный перед конденсором, выделяет область спектра источника света, которая вызывает люминесценцию объекта; другой, находящийся между объективом и окуляром, выделяет свет люминесценции. Подсчет таким образом меченных флуоресцирующих клеток используется в иммунологических исследованиях крови.
На основе фотолюминесценции созданы источники света, спектр которых больше соответствует дневному свету, чем у ламп накаливания. Это имеет значение как для производственных целей, так и для гигиенических. В таких люминесцентных лампах, называемых лампами дневного света, происходит электрический разряд в парах ртути при низком давлении (электролюминесценция). На внутренней поверхности лампы, сделанной из обычного стекла (рис. 24.11), нанесен тонкий слой люминофора, который фотолюминесцирует под воздействием излучения паров ртути.

Изменяя состав люминофора, можно подобрать наиболее подходящий спектр фотолюминесценции. На рис. -24.12 показан один из возможных спектров, интенсивные линии соответствуют спектру паров ртути, излучение которых частично проходит через люминофор.
§ 24.7. Хемилюминесценция
Хемилюминесценцией называют свечение, сопровождающее химические реакции. Наличие такого свечения означает, что энергия, которая выделяется на одной из стадий химического процесса, протекающего в системе, оказывается достаточной для образования одного из продуктов реакции в электронно-возбужденном состоянии (обозначается звездочкой):
А + В -> Р* + другие продукты
Р* -> Р + hv (хемилюминесценция)
Среди огромного разнообразия химических реакций лишь единичные сопровождаются излучением в видимой или ультрафиолетовой областях спектра, которое удается измерить. Наиболее изучены следующие типы процессов, сопровождающихся свечением.
Биолюминесценция — яркое, видимое простым глазом свечение некоторых бактерий, простейших, ракообразных, червей, моллюсков, рыб. Хорошо известна биолюминесценция светляков. Биолюминесценция обусловлена определенными ферментативными реакциями.
Хемилюминесценция в системах, содержащих активные формы кислорода: пероксид водорода, супероксидный и гидроксидный радикалы, синглетный (электронно-возбужденный) кислород.
Хемилюминесценция сопровождает реакции цепного (свободнорадикального, пероксидного) окисления органических соединений. Основной вклад в слабую хемилюминесценцию (раньше ее называли сверхслабым свечением) тканей, гомогенатов, растворов и суспензий полиненасыщенных жирных кислот дает свечение, сопровождающее пероксидное окисление липидов.
Хемилюминесценция при реакциях свободных радикалов, образовавшихся при действии физических факторов подразделяется на следующие виды: радиохемилюминесценция (при воздействии ионизирующего излучения); фотохемилюминесценция (после облучения видимым или УФ-светом); электрохемилюми-несценция (при пропускании электрического тока через растворы); сонолюминесценция (при воздействии ультразвука); трибо-люминесценция (при перемешивании растворов) и др.
При облучении (или освещении) веществ в твердой фазе (как частный случай — при облучении биологических объектов, суспензий или растворов, замороженных жидким азотом) подвижность свободных радикалов резко ограничивается. Их реакции и сопутствующая хемилюминесценция активируются при нагревании и размягчении среды. Такое свечение называют термолюминесценцией.

Измерение характеристик хемилю-минесценции — удобный метод контроля за течением химических реакций, сопровождающихся свечением, и, следовательно, может использоваться для изучения кинетики и механизма реакций. Регистрация хемилю-минесценции в ряде случаев является наиболее чувствительным методом обнаружения свободных радикалов.
На рис. 24.13 показана хемилюминесценция плазмы крови при выведении в нее ионов двухвалентного железа. Железо инициирует пероксидное окисление липидов. Кванты хемилюминесценции излучаются триплетными возбужденными кетонами, образующимися при рекомбинации пероксид-ных свободных радикалов (обозначены жирными точками)
Хемилюминесценция фагоцитирующих клеток крови при добавлении к ним различных образцов промышленной пыли значительно различается: по характеру кривых свечения клеток можно оценивать токсичность пыли. Токсичная пыль активирует ферментативную систему клеток, вырабатывающую супероксидные О*2 и гидроксильные *ОН радикалы и другие активные формы кислорода. Активность фагоцитирующих клеток также резко меняется при ишемической болезни сердца, инфаркте и других заболеваниях, поэтому хемилюминесценция этих клеток используется как диагностический метод.
§ 24.8. Лазеры и их применение в медицине
Несмотря на общую природу световых и радиоволн, многие годы оптика и радиоэлектроника развивались самостоятельно, независимо друг от друга. Казалось, что источники света — возбужденные частицы и генераторы радиоволн — имеют мало общего. Лишь с середины XX столетия появились работы по созданию молекулярных усилителей и генераторов радиоволн, которые положили начало новой самостоятельной области физики — квантовой электронике.
Квантовая электроника изучает методы усиления и генерации электромагнитных колебаний с использованием вынужденного излучения квантовых систем. Достижения в этой области знаний находят все большее применение в науке и технике.

Ознакомимся с некоторыми явлениями, лежащими в основе квантовой электроники и работы оптических квантовых генераторов — лазеров.
Создание лазеров оказалось возможным в результате реализации трех фундаментальных физических идей: вынужденного излучения (1), создания термодинамически неравновесной инверсной населенности энергетических уровней атомов (2) и использования положительной обратной связи (3).
Возбужденные молекулы (атомы) способны излучать фотоны люминесценции (см. § 24.5—24.6). Такое излучение является спонтанным процессом (рис. 24.14, а). Оно случайно и хаотично по времени, частоте (могут быть переходы между разными уровнями), по направлению распространения и поляризации. Другое излучение — вынужденное, или индуцированное (рис. 24.14, б) — возникает при взаимодействии фотона с возбужденной молекулой, если энергия фотона равна разности соответствующих уровней энергии (23.31). При вынужденном (индуцированном) излучении число переходов, совершаемых в секунду, зависит от числа фотонов, попадающих в вещество за это же время, т. е. от интенсивности света, а также от числа возбужденных молекул. Другими словами, число вынужденных переходов будет тем больше, чем выше населенность соответствующих возбужденных энергетических состояний.
Индуцированное излучение тождественно падающему во всех отношениях, в том числе и по фазе, поэтому можно говорить о когерентном усилении электромагнитной волны, что используется в качестве первой основополагающей идеи в принципах лазерной генерации.

В обычных условиях вынужденное излучение маловероятно. На рис. 24.15 показано «заселение» молекулами энергетических уровней, описываемое распределением Больцмана (24.24). На рисунке «длина» каждого уровня пропорциональна числу частиц, имеющих соответствующую энергию (Ео — основное состояние, Е 1, Е2, ..., — возбужденные состояния, N — общее число частиц, Ni — число частиц на i-ом уровне энергии). Видно, что при «низких» температурах количество возбужденных молекул чрезвычайно мало, при повышении температуры оно увеличивается, при «высокой» температуре практически все энергетические уровни будут заселены одинаково. В любом случае, когда система находится в тепловом равновесии с окружающей средой (наиболее часто встречающаяся ситуация), большая часть молекул находится в основном состоянии. Поэтому фотоны будут сталкиваться, главным образом, с невозбужденными молекулами и будет происходить поглощение света. Для отдельной частицы равновероятны вынужденное поглощение, если частица находится в основном состоянии (рис. 24.14, в), и вынужденное излучение, если частица возбуждена (рис. 24.14, б). Поэтому даже если число возбужденных частиц в веществе равно числу невозбужденных («высокая» температура на рис. 24.15), усиления падающей электромагнитной волны не будет. На самом деле в обычном состоянии вещества («низкая» температура на рис. 24.15) условия для усиления волны не выполняются, т. е. волна при прохождении среды поглощается.
Вторая идея, реализуемая при создании лазеров, заключается в создании термодинамически неравновесных систем, в которых, вопреки закону Больцмана, на более высоком уровне находится больше частиц, чем на более низком. Состояние среды, в котором хотя бы для двух энергетических уровней оказывается, что число частиц с большей энергией превосходит число частиц с меньшей энергией, называется состоянием с инверсной населенностью уровней, а среда — активной. Именно активная среда, в которой фотоны взаимодействуют с возбужденными атомами, вызывая вынужденные переходы на более низкий уровень с испусканием квантов индуцированного (вынужденного) излучения, является рабочим веществом лазера. Состояние с инверсной населенностью уровней формально получается из распределения Больцмана для Т < 0 К, поэтому иногда называется состоянием с «отрицательной» температурой. По мере распространения света в активной среде интенсивность его возрастает, имеет место явление, обратное поглощению, т. е. усиление света. Это означает, что в законе Бугера (24.3) kl < 0, поэтому инверсная населенность соответствует среде с отрицательным показателем поглощения. Состояние с инверсной населенностью можно создать, отбирая частицы с меньшей энергией или специально возбуждая частицы, например, светом или электрическим разрядом. Само по себе состояние с отрицательной температурой долго не существует.
Третья идея, используемая в принципах лазерной генерации, возникла в радиофизике и заключается в использовании положительной обратной связи. При ее осуществлении часть генерируемого вынужденного излучения остается внутри рабочего вещества и вызывает вынужденное излучение все новыми и новыми возбужденными атомами. Для реализации такого процесса активную среду помещают в оптический резонатор, состоящий обычно из двух зеркал, подобранных так, чтобы возникающее в нем излучение многократно проходило через активную среду, превращая ее в генератор когерентного вынужденного излучения.
Первый такой генератор в диапазоне СВЧ (мазер) был сконструирован в 1955 г. независимо советскими учеными Н. Г. Басовым и А. М. Прохоровым и американскими — Ч. Таунсом и др.1. Так как работа этого прибора была основана на вынужденном излучении молекул аммиака, то генератор был назван молекулярным.
В 1960 г. был создан первый квантовый генератор видимого диапазона излучения — лазер2 с кристаллом рубина в качестве рабочего вещества (активной среды). В том же году был создан газовый гелий-неоновый лазер. Все огромное многообразие созданных в настоящее время лазеров можно классифицировать по видам рабочего вещества: различают газовые, жидкостные, полупроводниковые и твердотельные лазеры. В зависимости от типа лазера энергия для создания инверсной населенности сообщается разными способами: возбуждение очень интенсивным светом — «оптическая накачка», электрическим газовым разрядом, в полупроводниковых лазерах — электрическим током. По характеру свечения лазеры подразделяют на импульсные и непрерывные.
Рассмотрим принцип работы твердотельного рубинового лазера. Рубин — это кристалл окиси алюминия А12О3, содержащий в виде примеси примерно 0,05% ионов хрома Сг3+. Возбуждение ионов хрома осуществляют методом оптической накачки с помощью импульсных источников света большой мощности.
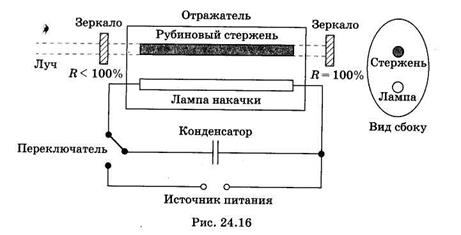
В одной из конструкций применяют трубчатый отражатель, имеющий в сечении форму эллипса. Внутри отражателя помещены прямая ксеноновая импульсная лампа и рубиновый стержень, расположенные вдоль линий, проходящих через фокусы эллипса (рис. 24.16). Внутренняя поверхность алюминиевого отражателя хорошо отполирована или посеребрена. Основное свойство эллиптического отражателя заключается в том, что свет, вышедший из одного его фокуса (ксеноновой лампы) и отраженный от стенок, попадает в другой фокус отражателя (рубиновый стержень).
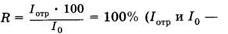
|
Рубиновый лазер работает по трехуровневой схеме (рис. 24.17, а). В результате оптической накачки ионы хрома переходят с основного уровня 1в короткоживущее возбужденное состояние З3. Затем происходит безызлучательный переход в долгоживущее (метастабильное) состояние 2, с которого вероятность спонтанного излучательного перехода относительно мала. Поэтому происходит накопление возбужденных ионов в состоянии 2 и создается инверсная населенность между уровнями 1 и 2. В обычных условиях переход со 2-го на 1-й уровень происходит спонтанно и сопровождается люминесценцией с длиной волны 694,3 нм. В резонаторе лазера есть два зеркала (см. рис. 24.16), одно из которых имеет коэффициент отражения интенсивности отраженного и падающего на зеркало света), другое зеркало полупрозрачное и пропускает часть падающего на него излучения (R < 100%).
Кванты люминесценции в зависимости от направления их движения либо вылетают из боковой поверхности рубинового стержня и теряются, либо, многократно отражаясь от зеркал, сами вызывают вынужденные переходы. Таким образом, пучок, перпендикулярный зеркалам, будет иметь наибольшее развитие и выходит наружу через полупрозрачное зеркало. Такой лазер работает в импульсном режиме.
Наряду с рубиновым лазером, работающим по трехуровневой схеме, широкое распространение получили четырехуровневые схемы лазеров на ионах редкоземельных элементов (неодим, самарий и др.), внедренных в кристаллическую или стеклянную матрицы (рис. 24.17, б). В таких случаях инверсная населенность создается между двумя возбужденными уровнями: долгоживу-щим уровнем 2 и короткоживущим уровнем 2'.
Очень распространенным газовым лазером является гелий-не-оновАй, возбуждение в котором возникает при электрическом разряде. Активной средой в нем служит смесь гелия и неона в соотношении 10 : 1 и давлении около 150 Па. Излучающими являются атомы неона, атомы гелия играют вспомогательную роль. На рис. 24.17, в показаны энергетические уровни атомов гелия и неона. Генерация происходит при переходе между 3 и 2 уровнями неона. Для того чтобы создать между ними инверсную населенность, необходимо заселить уровень 3 и опустошить уровень 2. Заселение уровня 3 происходит с помощью атомов гелия. При электрическом разряде электронным ударом происходит возбуждение атомов гелия в долгоживущее состояние (со временем жизни около 10-3 с). Энергия этого состояния очень близка к энергии уровня 3 неона, поэтому при соударении возбужденного атома гелия с невозбужденным атомом неона происходит передача энергии, в результате чего заселяется уровень 3 неона. Для чистого неона время жизни на этом уровне мало и атомы переходят на уровни 1 или 2, реализуется больцмановское распределение. Опустошение уровня 2 неона происходит в основном за счет спонтанного перехода его атомов в основное состояние при соударениях со стенками разрядной трубки. Так обеспечивается стационарная инверсная населенность уровней 2 и 3 неона.
 Основным конструктивным элементом гелий-неонового лазера (рис. 24.18) является газоразрядная трубка диаметром около 7 мм. В трубку вмонтированы электроды для создания газового разряда и возбуждения гелия. На концах трубки под углом Брюстера (§ 20.2) расположены окна, благодаря которым излучение оказывается плоскополяризованным. Плоскопараллельные зеркала резонатора монтируются вне трубки, одно из них полупрозрачное (коэффициент отражения R < 100%). Таким образом, пучок вынужденного излучения выходит наружу через полупрозрачное зеркало. Это лазер непрерывного действия. Так как уровни 2 и 3 неона обладают сложной структурой (на рис. 24.17, в не показано), то гелий-неоновый лазер может работать на 30 длинах волн в области видимого и инфракрасного диапазонов.
Основным конструктивным элементом гелий-неонового лазера (рис. 24.18) является газоразрядная трубка диаметром около 7 мм. В трубку вмонтированы электроды для создания газового разряда и возбуждения гелия. На концах трубки под углом Брюстера (§ 20.2) расположены окна, благодаря которым излучение оказывается плоскополяризованным. Плоскопараллельные зеркала резонатора монтируются вне трубки, одно из них полупрозрачное (коэффициент отражения R < 100%). Таким образом, пучок вынужденного излучения выходит наружу через полупрозрачное зеркало. Это лазер непрерывного действия. Так как уровни 2 и 3 неона обладают сложной структурой (на рис. 24.17, в не показано), то гелий-неоновый лазер может работать на 30 длинах волн в области видимого и инфракрасного диапазонов.
Зеркала резонатора делают с многослойными покрытиями, и вследствие интерференции создается необходимый коэффициент отражения для заданной длины волны. Чаще всего используются гелий-неоновые лазеры, излучающие красный свет с длиной волны 632,8 нм. Мощность таких лазеров небольшая, она не превышает 100 мВт.
Применение лазеров основано на свойствах их излучения: высокая монохроматичность (Dl»0,01 нм), достаточно большая мощность, узость пучка и когерентность.
Узость светового пучка и малая его расходимость позволили использовать лазеры для измерения расстояния между Землей и Луной (получаемая точность — около десятков сантиметров), скорости вращения Венеры и Меркурия и др.
На когерентности лазерного излучения основано их применение в голографии (см. § 19.8). На основе гелий-неонового лазера с использованием волоконной оптики разработаны гастроскопы, которые позволяют голографически формировать объемное изображение внутренней полости желудка.
Монохроматичность лазерного излучения очень удобна при возбуждении спектров комбинационного рассеяния света атомами и молекулами (см. § 24.3).
Широкое применение лазеры нашли в хирургии, стоматологии, офтальмологии, дерматологии, онкологии. Биологические эффекты лазерного излучения зависят как от свойств биологического материала, так и от свойств лазерного излучения.
Все лазеры, используемые в медицине, условно подразделяются на 2 вида: низкоинтенсивные (интенсивность не превышает 10 Вт/см2, чаще всего составляет около 0,1 Вт/см2) — терапевтические и высокоинтенсивные — хирургические. Интенсивность наиболее мощных лазеров может достигать 1014 Вт/см2, в медицине обычно используются лазеры с интенсивностью 102— 106 Вт/см2.
Низкоинтенсивные лазеры — это такие, которые не вызывают заметного деструктивного действия на ткани непосредственно во время облучения. В видимой и ультрафиолетовой областях спектра их эффекты обусловлены фотохимическими реакциями и не отличаются от эффектов, вызываемых монохроматическим светом, полученным от обычных, некогерентных источников (см. § 24.9). В этих случаях лазеры являются просто удобными монохроматическими источниками света, обеспечивающими точную локализацию и дозированность воздействия. Примерами может служить использование света гелий-неоновых лазеров для лечения трофических язв, ишемической болезни сердца и др., а также криптоновых и др. лазеров для фотохимического повреждения опухолей в фотодинамической терапии.
Качественно новые явления наблюдаются при использовании видимого или ультрафиолетового излучения высокоинтенсивных лазеров. В лабораторных фотохимических экспериментах с обычными источниками света, а также в природе при действии солнечного света обычно осуществляется однофотонное поглощение. Об этом говорится во втором законе фотохимии4,сформулированном Штарком и Эйнштейном: каждая молекула, участвующая в химической реакции, идущей под действием света, поглощает один квант излучения, который вызывает реакцию.Однофотонность поглощения, описываемая вторым законом, выполняется потому, что при обычных интенсивностях света практически невозможно одновременное попадание в молекулу, находящуюся в основном состоянии, двух фотонов. Если бы такое событие осуществилось, то выражение (23.31) приобрело бы вид:
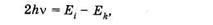
что означало бы суммирование энергии двух фотонов для перехода молекулы из энергетического состояния Ек в состояние с энергией Et. He происходит также поглощения фотонов электронно-возбужденными молекулами, так как их время жизни мало, а обычно используемые интенсивности облучения невелики.
Поэтому концентрация электронно-возбужденных молекул низка, и поглощение ими еще одного фотона чрезвычайно маловероятно.
Однако если увеличить интенсивность света, то становится возможным двухфотонное поглощение. Например, облучение растворов ДНК высокоинтенсивным импульсным лазерным излучением с длиной волны около 266 нм приводило к ионизации молекул ДНК, подобной вызываемой у-излучением. Воздействие ультрафиолета с низкой интенсивностью ионизации не вызывало. Установлено, что при облучении водных растворов нуклеиновых кислот или их оснований пикосекундными (длительность импульса 30 пс) или наносекундными (10 нс) импульсами с интенсивностями выше 106 Вт/см2 приводило к электронным переходам, показанным на рис. 24.19, завершавшимся ионизацией молекул.
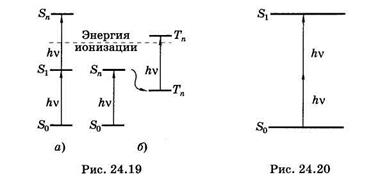
 При пикосекундных импульсах (рис. 24.19, а) заселение высоких электронных уровней происходило по схеме
При пикосекундных импульсах (рис. 24.19, а) заселение высоких электронных уровней происходило по схеме
а при наносекундных (рис. 24.19, б) — по схеме

В обоих случаях молекулы получали энергию, превышающую энергию ионизации.
Полоса поглощения ДНК располагается в ультрафиолетовой области спектра при l < 315 нм, видимый свет нуклеиновые кислоты совсем не поглощают. Однако воздействие высокоинтенсивным лазерным излучением около 532 нм переводит ДНК в электронно-возбужденное состояние за счет суммирования энергии двух фотонов (рис. 24.20).
Поглощение любого излучения приводит к выделению некоторого количества энергии в виде тепла, которое рассеивается от возбужденных молекул в окружающее пространство. Инфракрасное излучение поглощается главным образом водой и вызывает в основном тепловые эффекты. Поэтому излучение высокоинтенсивных инфракрасных лазеров вызывает заметное немедленное тепловое действие на ткани. Под тепловым воздействием лазерного излучения в медицине понимают в основном испарение (резание) и коагуляцию биотканей. Это касается различных лазеров с интенсивностью от 1 до 107 Вт/см2 и с продолжительностью облучения от миллисекунд до нескольких секунд. К ним относятся, например, газовый СО2-лазер (с длиной волны 10,6 мкм), Nd:YAG-лазер (1,064 мкм) и другие. Nd:YAG-лaзep — наиболее широко используемый твердотельный четырехуровневый лазер. Генерация осуществляется на переходах ионов неодима (Nd3+), введенных в кристаллы Y3A15O12 иттрий-алюминиевого граната (YAG).
Наряду с нагревом ткани происходит отвод части тепла за счет теплопроводности и тока крови. При температурах ниже 40 °С необратимые повреждения не наблюдаются. При температурах 60 °С и выше начинается денатурация белков, коагуляция тканей и некроз. При 100— 150 °С вызывается обезвоживание и обугливание, а при температурах свыше 300 °С ткань испаряется.

Когда излучение исходит от высокоинтенсивного сфокусированного лазера, количество выделяющегося тепла велико, в ткани возникает температурный градиент. В месте падения луча ткань испаряется, в прилегающих областях происходит обугливание и коагуляция (рис. 24.21). Фотоиспарение является способом послойного удаления или разрезания ткани. В результате коагуляции завариваются сосуды и останавливается кровотечение. Так сфокусированным лучом непрерывного СО2-лазера (l = 10,6 мкм) с мощностью около 2 • 103 Вт/см2 пользуются как хирургическим скальпелем для разрезания биологических тканей.
Если уменьшать длительность воздействия (10-9—10-6 с) и увеличивать интенсивность (выше 106 Вт/см2), то размеры зон обугливания и коагуляции становятся пренебрежимо малыми. Такой процесс называют фотоабляцией (фотоудалением) и используют для послойного удаления ткани. Фотоабляция возникает при плотностях энергии 0,01—100 Дж/см2.
При дальнейшем повышении интенсивности (1011 Вт/см2 и выше) возможен еще один процесс — «оптический пробой». Это явление заключается в том, что из-за очень высокой напряженности электрического поля лазерного излучения (сравнимой с напряженностью внутриатомных электрических полей) материя ионизуется, образуется плазма и генерируются механические ударные волны. Для оптического пробоя не требуется поглощения квантов света веществом в обычном смысле, он наблюдается также в прозрачных средах, например в воздухе.

1 В 1964 г. Н. Г. Басову, А. М. Прохорову и Ч. Таунсу за эти работы
была присуждена Нобелевская премия.
2 2 Название «лазер» является аббревиатурой от англ. Light Amplifica
tion by Stimulated Emission of Radiation (усиление света посредством вы
нужденного излучения).
3 3 На этой редуцированной схеме представлены только те уровни и переходы между ними, которые существенны для генерации лазерного излучения. На самом деле схема электронных уровней гораздо сложнее. На схеме не отражена ширина энергетических уровней. Так, короткоживу-щий уровень 3 является широким и поглощает большую часть спектра излучения лампы накачки.
4 Фотохимия изучает химические реакции, протекающие под действием света.
§ 24.9. Фотобиологические процессы. Понятия о фотобиологии и фотомедицине
Фотобиологическими называют процессы, которые начинаются с поглощения квантов света молекулами, а заканчиваются физиологической реакцией организма.
К фотобиологическим процессам относятся фотосинтез, зрение, загар и эритема кожи, фотопериодизм и многие другие.
Условно всякий фотобиологический процесс можно разбить на несколько стадий:
1) 1) поглощение кванта света молекулой;
2) 2) внутримолекулярные процессы размена энергии;
3) 3) межмолекулярные процессы переноса энергии электронно-возбужденного состояния (важны в некоторых фотобиологических процессах);
4) 4) первичный фотохимический акт, сопровождающийся образованием короткоживущих, нестабильных фотопродуктов, в него молекула вступает из нижнего синглетного S1 или триплетного Т1 возбужденных состояний;
5) 5) реакции нестабильных фотопродуктов, заканчивающиеся образованием стабильных продуктов;
6) 6) биохимические реакции с участием фотопродуктов;
7) 7) физиологический ответ на действие света.
Первые три стадии фотобиологических процессов одинаковы для фотохимических реакций и фотолюминесценции. Поэтому законы фотохимии имеют свои аналогии с законами люминесценции (см. § 24.6). Первичный фотохимический акт заключается в
химических изменениях молекулы (например, присоединении или отдаче электрона или водорода).
Особенностью биологического действия ультрафиолетового и видимого излучения (200—750 нм)1 является ярко выраженная зависимость биологического эффекта от длины волны излучения. Бактерицидные эффекты вызываются волнами в диапазоне 200— 315 нм, покраснение (эритема) кожи наиболее эффективно вызывается излучением с длиной волн 280—315 нм, зрительный эффект — 400—750 нм (видимый диапазон), лечение желтухи новорожденных — фиолетовым светом (около 400 нм). При фотосинтезе растения и фотосинтезирующие бактерии используют весь диапазон солнечного ультрафиолетового излучения, достигающего поверхности Земли (коротковолновая граница солнечного света, проходящего через атмосферу Земли, ~ 285 нм), видимого света, и даже ближнего инфракрасного излучения (иногда до 1000 нм).
Меняя длину волны, можно избирательно инициировать те или иные фотобиологические процессы2. Дело в том, что разные фотобиологические процессы начинаются с поглощения квантов света разными молекулами, в свою очередь положение полосы поглощения молекулы зависит от ее химической структуры (см. § 24.4).
Важной характеристикой воздействия света на биологические объекты является спектр фотобиологического действия — зависимость биологического эффекта от длины волны действующего света. Спектры действия позволяют определить, какая область спектра наиболее эффективно вызывает биологический процесс, а также определить природу молекул, ответственных за поглощение света в данном процессе.
Рассмотрим количественно начальные этапы этого процесса: поглощение света и первичную фотохимическую реакцию.
По аналогии с рассуждениями § 24.1, введем понятие эффективного сечения поглощения молекулой фотона s. Отличие от вывода закона Бугера—Ламберта—Бера заключается, по крайней мере, в следующем: во-первых, будем учитывать уменьшение числа активируемых молекул, так как воздействие света вызывает их химические превращения; во-вторых, рассмотрим достаточно тонкий слой разбавленного раствора, это позволит считать интенсивность света I0 постоянной и одинаковой по всей толщине слоя раствора.
Элементарное уменьшение концентрации dn молекул под действием света пропорционально:
— — концентрации п молекул;
— — эффективному сечению поглощения s;
— — времени облучения dt;
— — интенсивности света 103:
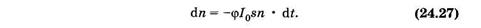
Здесь знак «-» означает уменьшение числа молекул со временем.
Коэффициент (jх называют квантовым выходом фотохимической реакции. Этот коэффициент показывает, какая часть молекул, которые поглотили фотоны, вступила в фотохимическую реакцию. Разделим переменные и проинтегрируем (24.27):
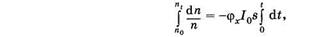
где п0 — начальная концентрация молекул, a ni — концентрация молекул в момент i. Получаем 
или
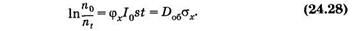
Здесь Iot = Do6 — доза облучения, a sjx = sх — эффективное сечение молекулы для фотохимического превращения, оно пропорционально вероятности такого взаимодействия фотона с молекулой, в результате которого произойдет фотохимическая реакция.
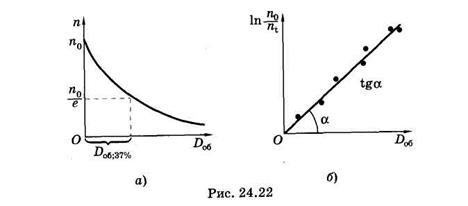
Для нахождения sх строят график зависимости ln n0/ni = f(Do6) и
по наклону прямой [см. (24.28)] определяют эту величину (рис. 24.22, б). Можно найти sх непосредственно на дозовой кривой фотолиза4 вещества (рис. 24.22, а)

где Do6.37% — доза облучения, при которой концентрация вещества уменьшилась в е раз, другими словами, осталось неразрушенными 37% молекул.
В фотохимии спектром действия называют зависимость sх(l). Эту зависимость можно найти, используя связь sх = sjx. Дело в том, что квантовый выход фотохимических реакций (подобно квантовому выходу флуоресценции, см. § 24.6) в растворах не зависит от длины волны действующего света, т. е. jх(l) = const. Физически это означает, что независимо от энергии возбуждения hv молекула сначала израсходует часть этой энергии, пока не перейдет в нижнее возбужденное состояние (см. § 24.6 и рис. 23.16), и только после этого сможет начать фотохимическое превращение. Учитывая это, можно заключить, что спектр действия jх(l) и спектр поглощения (см. § 24.4) — зависимость s(l) — имеют одинаковый вид, так как различаются только постоянным множителем jх. Такая особенность позволяет, сопоставляя спектр действия фотохимической реакции со спектрами поглощения содержащихся в объекте соединений, определить, какое из них поглощает фотоны, вызывающие фотохимические превращения.
Описанная методика определения спектров действия может быть применена к исследованию бактерицидного действия света. Сходство процессов при фотолизе молекул в растворе и при фотоинактивации бактерий в суспензии заключается в следующем. Под действием поглощенного кванта молекула либо совсем не изменится, либо превратится в фотопродукт, т. е. возможны только два исхода, причем вероятность фотолиза определяется квантовым выходом jх. Точно так же при поглощении кванта бактерией она либо останется живой, либо погибнет. Концентрацию жизнеспособных бактерий можно определить подобно концентрации неразрушенных молекул в растворе. Вероятность гибели бактерии при поглощении кванта определяется квантовым выходом бактерицидного эффекта и (так же как при фотолизе молекул) не зависит от длины волны действующего света. Поэтому если в формулы (24.27)—(24.29) вместо концентрации молекул подставить концентрацию бактерий, то можно найти ох для бактерицидного эффекта и построить спектр действия. Так, например, было установлено, что кривая гибели бактерий под действием УФ-излучения (спектр фотобиологического действия) подобна спектру поглощения нуклеиновых кислот, представляющему широкую неструктурированную полосу в диапазоне длин волн 200—315 нм с максимумом при 260 нм. Это дало основание сделать вывод, что гибель бактерий обусловлена повреждением именно нуклеиновых кислот. На этом основано использование в медицине для обеззараживания помещений ртутных бактерицидных ламп, излучающих монохроматический свет с длиной волны 254 нм, что соответствует максимуму спектра действия бактерицидного эффекта.
Сложнее дело обстоит в случае таких процессов, как эритема кожи. Эритема заключается в расширении кровеносных сосудов кожи, что видно по ее покраснению. Зависимость степени покраснения от дозы характеризуется наличием пороговой дозы (минимальной эритемной дозы, МЭД), вызывающей едва различимое глазом покраснение. Подпороговые дозы эритему не вызывают совсем. При увеличении дозы облучения степень покраснения растет пропорционально логарифму дозы. Здесь отсутствуют количественные показатели, подобные числу разрушенных молекул или погибших клеток, которые можно было бы использовать для расчета sх. Выход из положения был найден при введении следующего предположения. Если облучать кожу разными длинами волн и при этом подбирать каждый раз дозу так, чтобы возникающий эффект (степень покраснения) был одинаков, то можно думать, что одинаковая степень покраснения (стандартный эффект) является результатом одинаковых фотохимических повреждений. В качестве стандартного эффекта обычно выбирают минимальное покраснение, вызываемое МЭД. Величина МЭД является функцией длины волны действующего света. По аналогии с (24.29) было предложено определять величину эритемной эффективности как 1/МЭД. Предполагается, что 1/МЭД пропорциональна sх, подобно 1/-Do6;37% из выражения (24.29). Спектры действия эритемы представлены на рис. 24.23, кривая 1измерена через 8 часов после облучения, 2 — через 24 часа и 3 — через 10 суток. Выяснилось, что динамика развития, длительность существования и степень покраснения кожи сильно зависят от длины волны действующего света.

На этом основании в медицине весь диапазон УФ-излучения принято подразделять на три области: УФ-А (320— 400 нм), УФ-В (280—320 нм) и УФ-С (l < 280 нм). УФ-А-излучение наименее эффективно. УФ-В-излучение способно вызывать наиболее интенсивную и длительную эритему, переходящую при дозах более 10 МЭД в эдему (ожог кожи). УФ-С-излучение может вызвать только умеренное покраснение, ни при каких дозах не
переходящее в эдему. Регистрация спектров действия эритемы покатала, что данная реакция кожи является следствием суммирования двух или трех фотохимических процессов, каждый из которых по-разному зависит от длины волны действующего света. В случае других сложных фотобиологических процессов можно для регистрации спектров действия использовать величину биологической эффективности света (БЭС), обратную дозе облучения, вызывающей стандартный биологический эффект Do6 ст
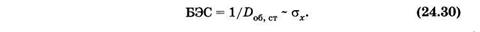
Изучение спектров действия показало, что УФ-В-излучение наиболее эффективно вызывает не только эритему, но также пигментацию и рак кожи, кроме того, оно подавляет Т-клеточное звено иммунитета и вызывает многие другие эффекты у человека и животных. Отсюда понятно внимание, уделяемое состоянию озонового слоя атмосферы. Озон является естественным светофильтром, определяющим коротковолновую границу солнечного излучения, достигающего поверхности Земли. В ясный полдень на экваторе на высоте моря коротковолновая граница проходит вблизи 285 нм. Суммарно УФ-В-излучение составляет менее 1,5% энергии солнечного света, но обусловливает наиболее острые фотобиологические эффекты. Уменьшение озонового слоя резко увеличивает количество УФ-В-излучения, что крайне опасно для живых организмов.
Сопоставление спектров действия со спектрами поглощения содержащихся в биологическом объекте молекул позволяет определить, какие молекулы поглощают фотоны, запускающие исследуемый фотобиологический процесс. Такие фотобиологические процессы, как зрительный эффект, фотомутагенез, фотоканцерогенез, эритема и др., индуцируются под действием света, поглощаемого нормально содержащимися в объекте молекулами, например, зрительными пигментами, нуклеиновыми кислотами, белками и др. В некоторых случаях наблюдается резкое повышение светочувствительности биологических систем в результате попадания в них экзогенных (посторонних) молекул, способных поглощать ультрафиолет или видимый свет. Вещества, повышающие чувствительность биообъектов к свету, называют фотосенсибилизаторами, а инициируемые ими фотобиологические процессы — фотосенсибилизированными. Форма спектра действия такого процесса совпадает со спектром поглощения соответствующего фотосенсибилизатора.
Определение вида молекул, поглотивших свет, существенно потому, что свойства электронно-возбужденных молекул сильно отличаются от свойств тех же молекул в основном (невозбужденном) состоянии. Благодаря такому изменению свойств молекул и инициируются фотобиологические процессы.
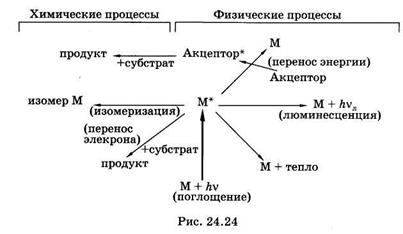
Молекула (М) обязательно избавляется от избыточной энергии, расходуя ее либо в физических процессах, либо в фотохимических реакциях. Основные пути расходования энергии возбужденных молекул (М*) показаны на рис. 24.24. Может произойти безызлуча-тельный переход энергии в тепло, либо излучение квантов люминесценции с возвращением молекулы в основное состояние (§ 24.6).
Все многообразие фотохимических реакций электронно-возбужденных молекул сводится к фотоизомеризации или переносу электрона между возбужденной молекулой и субстратом.
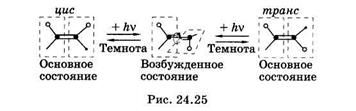
Фотоизомеризация — это изменение пространственной структуры молекул,осуществляющееся в электронно-возбужденном состоянии.Известно, что у органических молекул, находящихся в основном состоянии, невозможно вращение их частей вокруг двойных связей. Такие молекулы имеют плоскую цис- или торакс-конфигурацию (рис. 24.25). Это связано с особенностями  перекрывания p-орбиталей при образовании второй связи (см. рис. 23.15, б). Для того чтобы повернуть две части молекулы вокруг двойной связи, нужно уменьшить области перекрывания p-орбиталей, для этого нужно затратить значительную энергию (кривая с индексом So на рис. 24.26), такой процесс самопроизвольно произойти не может. Наименьшую энергию молекула имеет при перекрывании p-орбиталей, поэтому p-орбитали называют связывающими. При поглощении фотона и переходе в возбужденное состояние молекула сразу после перехода сохраняет плоскую конфигурацию основного состояния. Но возбужденные p*-орбитали (S1 или Т1 состояния на рис. 24.26) являются разрыхляющими: наименьшую энергию имеет конфигурация, в которой p-связь разрывается и две части молекулы поворачиваются вокруг s-связи на 90°. При возвращении молекулы в основное состояние она может претерпеть цис-тпранс- или транс-цис-изомеризицию; цис-транс-фотоизошеризащш пигмента ретиналя принадлежит ведущая роль в зрительной рецепции (см. § 24.10).
перекрывания p-орбиталей при образовании второй связи (см. рис. 23.15, б). Для того чтобы повернуть две части молекулы вокруг двойной связи, нужно уменьшить области перекрывания p-орбиталей, для этого нужно затратить значительную энергию (кривая с индексом So на рис. 24.26), такой процесс самопроизвольно произойти не может. Наименьшую энергию молекула имеет при перекрывании p-орбиталей, поэтому p-орбитали называют связывающими. При поглощении фотона и переходе в возбужденное состояние молекула сразу после перехода сохраняет плоскую конфигурацию основного состояния. Но возбужденные p*-орбитали (S1 или Т1 состояния на рис. 24.26) являются разрыхляющими: наименьшую энергию имеет конфигурация, в которой p-связь разрывается и две части молекулы поворачиваются вокруг s-связи на 90°. При возвращении молекулы в основное состояние она может претерпеть цис-тпранс- или транс-цис-изомеризицию; цис-транс-фотоизошеризащш пигмента ретиналя принадлежит ведущая роль в зрительной рецепции (см. § 24.10).
К фотохимическим превращениям молекулы, поглотившей фотон, приводят резкие изменения ее донорно-акцепторных свойств. Ввозбужденной молекуле освобождается электронная вакансия на верхней заполненной орбитали (So на рис. 23.16), в результате чего молекула становится акцептором электрона, способным вступать в реакции фотовосстановления с подходящими донорами. Примером такой реакции может служить открытая А. А. Красновским (1948) реакция фотовосстановления хлорофилла. Это открытие имело фундаментальное значение в познании процесса фотосинтеза. Наряду с этим в возбужденной молекуле появляется электрон на сравнительно высоко расположенной нижней свободной орбитали (S1 или Т1 на рис. 23.16). В результате этого молекула становится донором электрона и легко вступает в реакции фотоокисления. Так, возбужденные ароматические аминокислоты триптофан и тирозин способны отдавать электрон молекулам среды, что приводит к их ионизации.
Если рядом с возбужденной молекулой находится подходящий акцептор, то энергия может быть перенесена на него. Электронно-возбужденный акцептор может либо сам химически модифицироваться или вступить в реакцию с субстратом. Подобные реакции могут быть отнесены к фотосенсибилизированным.
Механизмы фотосенсибилизированных реакций крайне разнообразны. Практически удобно классифицировать их на два вида: нуждающиеся в присутствии кислорода и не нуждающиеся в нем. Фотобиологические эффекты, для осуществления которых требуется участие трех составляющих — света, кислорода и фотосенсибилизатора — принято называть фотодинамическими эффектами, а соответствующие фотосенсибилизаторы — фотодинамическими. Фотодинамические эффекты инициируются фотосенсибилизаторами из триплетного электронно-возбужденного состояния T1 (см. рис. 23.16).
Более детальная классификация фотосенсибилизированных реакций основана на природе реакционно-способных фотопродуктов, непосредственно реагирующих с субстратом. Рассмотрим этот вопрос на примере псораленов — фотосенсибилизаторов растительного происхождения, повышающих чувствительность биообъектов к УФ-А-излучению.
В реакциях типа I происходит перенос электрона (или водорода) между электронно-возбужденным фотосенсибилизатором и субстратом, сопровождающийся образованием свободных радикалов, которые взаимодействуют с молекулярным кислородом.
В реакциях типа II происходит перенос энергии от фотосенсибилизатора, находящегося в триплетном электронно-возбужденном состоянии T1 на молекулярный кислород по схеме:
|
| — поглощение света и образование триплетного |
состояния фотосенсибилизатора;
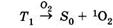
|
— перенос энергии и образование синглетного
электронно-возбужденного молекулярного кислорода. Образующийся при этом синглетный кислород 1О2 взаимодействует с субстратом, окисляя последний:
1О2 + субстрат -> окисленный субстрат.
В реакциях типа II фотосенсибилизатор работает подобно катализатору и в реакции не расходуется. Субстратами фотоокисления служат молекулы ДНК, белков, ненасыщенных липидов и другие.
В реакциях типа III участвуют электронно-возбужденные молекулы псораленов, предварительно в темноте встроившиеся в двуспиральную ДНК. При этом они ковалентно присоединяются к тимину, повреждая либо одну из нитей двуспиральной ДНК, либо образуя межнитевую сшивку в двуспиральной молекуле ДНК. Реакции типов I—IIIмогут осуществляться только в том случае, если субстрат облучается в присутствии фотосенсибилизатора. Это связано с коротким временем жизни реакционно-способных фотопродуктов. Так, время жизни синглетных и триплетных электронно-возбужденных состояний молекул составляет, соответственно, около 10-9 и 10-6 с, синглетного кислорода — около 10-6 с, свободных радикалов — микро- или миллисекунды. Невозможно фотомодифицировать субстрат, сначала отдельно облучив фотосенсибилизатор, а затем после выключения света добавив к нему субстрат.
Модификация субстрата путем добавления к нему предварительно облученных фотосенсибилизаторов возможна в реакциях типа IV. При облучении растворов фотосенсибилизаторов в присутствии кислорода в них образуются относительно стабильные продукты фотоокисления, имеющие время жизни от нескольких секунд до нескольких дней. Эти продукты фотоокисления при столкновениях с молекулами субстрата реагируют с ними, давая биологически активные конечные продукты.
Фотохимические реакции, инициируемые светом в тканях человека и животных, могут иметь как положительные, так и отрицательные последствия. Раздел медицины, посвященный лечебному применению или патологическим последствиям действия оптического излучения, называется фото медициной.
Известны терапевтические эффекты оптического излучения, осуществляющиеся за счет поглощения света молекулами, содержащимися в биологических тканях. Так, УФ-В-облучение кожи используется для лечения кожного заболевания — псориаза. Фототерапия без использования экзогенных фотосенсибилизаторов применяется для лечения желтухи новорожденных. Желтуха новорожденных возникает из-за накопления в крови аномально высоких концентраций продукта распада гемоглобина — билирубина. Это связано с тем, что в первые дни жизни у некоторых детей наблюдается недостаток фермента глюкуронилтрансферазы, превращающей плохо растворимый в воде билирубин в его водорастворимое производное. Гидрофобный билирубин склонен накапливаться в клетках мозга, что может приводить к необратимым изменениям в центральной нервной системе. Билирубин имеет максимум поглощения в синей области спектра. Под действием синего света билирубин легко фотоизомеризуется непосредственно в кровеносных сосудах, образуя водорастворимые продукты, легко выводящиеся из организма. Таким образом устраняются патологические последствия гипербилирубинемии.
Существует ряд терапевтических методов, называемых фотохимиотерапией, в которых используется совместное воздействие экзогенных фотосенсибилизаторов и света. Наиболее распространены два вида фотохимиотерапии: ПУВА-терапия кожных заболеваний и фотодинамическая терапия злокачественных новообразований.
В ПУВА-терапии5 в качестве фотосенсибилизаторов используются псоралены в сочетании с УФ-А-облучением кожи. Она эффективна при псориазе, витилиго, кожной Т-клеточной лимфоме и других дерматозах. При ПУВА-терапии в коже человека протекают все IV типа фотосенсибилизированных реакций, наиболее важны из них реакции типов III и IV.
Фотодинамическая терапия (ФДТ) используется для удаления опухолей, доступных для облучения светом. ФДТ основана на применении локализующихся в опухолях фотосенсибилизаторов, повышающих чувствительность тканей при их последующем облучении видимым светом. Часто в качестве фотосенсибилизаторов при ФДТ используют производные гематопорфирина, поглощающие в красной области спектра. Ведущую роль при ФДТ играют реакции типа П. Разрушение опухолей при ФДТ основано на трех эффектах: 1) прямое фотохимическое уничтожение клеток опухоли; 2) повреждение кровеносных сосудов опухоли, приводящее к ишемии и гибели опухоли; 3) ФДТ способно вызывать воспалительную реакцию, мобилизующую противоопухолевую иммунную защиту тканей организма.

1 Ультрафиолетовое излучение с длинами волн менее 200 нм используется редко. Оно поглощается кислородом воздуха, поэтому его действие можно изучать только в специальных условиях, например, в вакууме, из-за этого ультрафиолет с X < 200 нм называют вакуумным.
2 Избирательность действия отличает биологические эффекты света от эффектов ионизирующего излучения. Поглощение квантов рентгеновского или у-излучения осуществляется не молекулами, а атомами и не зависит от того, в состав каких молекул эти атомы входят (см. § 26.4). Поэтому поглощение ионизирующего излучения происходит в основном теми элементами, которых в организме больше. Так как наш организм на 80% состоит из воды, то радиохимические процессы приводят преимуще
ственно к появлению радикалов воды, которые в дальнейшем повреждают белки, нуклеиновые кислоты, липиды и др.
3 Здесь интенсивность выражена в числе фотонов, падающих на 1 м2
за 1 с.
4 Фотолиз — химическая модификация вещества под действием света.
5 Русское название этой терапии возникло путем транслитерации английской аббревиатуры PUVA, произошедшей от Psoralens + UVA-radia-tion.
§ 24.10. Биофизические основы зрительной рецепции
В этом параграфе описаны процессы, протекающие от момента поглощения кванта света молекулой зрительного пигмента до возникновения рецепторного потенциала на клеточной мембране палочки.
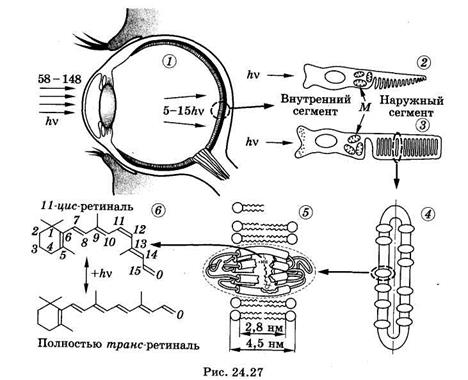
Сначала рассмотрим, как устроен зрительный рецептор. На рйс. 24.27 показаны: 1 — разрез глаза; 2 — колбочка; 3 — палочка (М — скопление митохондрий); 4 — диск наружного сегмента палочки; 5 — фрагмент мембраны диска со встроенной в нее молекулой родопсина; 6 — хромофорная группировка родопсина — ретиналь в 11-цис- и полностью-трамс-конформации. Свет, попавший в глаз (см. § 21.4), фокусируется оптической системой на слой светочувствительных клеток сетчатки — палочек и колбочек. Палочки (их около 125 млн) располагаются по всей поверхности полусферической сетчатки и отвечают за черно-белое, или сумеречное, зрение. Колбочек значительно меньше (примерно 6,5 млн). Они, главным образом, сконцентрированы в центральной части сетчатки, на прямой, проходящей через центры роговицы и хрусталика, и отвечают за цветовое зрение при достаточно ярком освещении.
Строение сетчатки человека и позвоночных животных на первый взгляд может показаться парадоксальным.
Светочувствительные клетки находятся в заднем слое сетчатки. Прежде чем свет попадет на них, он должен пройти через несколько слоев нервных клеток. Мало того, сами палочки и колбочки ориентированы к свету своим внутренним сегментом, не содержащим зрительного пигмента (см. рис. 24.27). Однако такая организация не снижает существенно чувствительности глаза к свету, так как нервные клетки и внутренние сегменты самих светочувствительных клеток прозрачны для видимого света.
Самые ранние исследования зрения касались порога чувствительности глаза. Абсолютный порог чувствительности зрения человека (т. е. минимальная еще обнаруживаемая энергия светового импульса при отсутствии светового фона и в условиях полной световой адаптации) равен 2,1 • 10-17 — 5,7 • 10-17 Дж на поверхности роговицы глаза, что соответствует 58—148 квантам сине-зеленого света. Однако из них только 5—15 квантов поглощаются собственно молекулами зрительного пигмента в палочках сетчатки, а остальные теряются. Около 4% света отражается от роговицы, около 50% поглощается оптическими средами глаза, при этом около 80—85% света, дошедшего до сетчатки, проходит сквозь нее и поглощается в клетках пигментного эпителия. Благодаря пигментному эпителию, подстилающему сетчатку, резко уменьшается количество отраженного и рассеянного от задней стенки глаза света, и тем самым улучшается острота зрения. Так как в сетчатке содержится 125 млн палочек, все кванты при пороговой интенсивности (а их всего 5—15) поглощаются разными палочками.
Рассмотрим строение и функции палочек (см. рис. 24.27). Зрительный пигмент палочек родопсин сосредоточен в наружных сегментах палочек, где он встроен в зрительные диски. Диски представляют собой замкнутые бимолекулярные липидные мембраны, напоминающие собой расплющенные воздушные шары, уложенные в стопку. Наружный сегмент соединен с внутренним сегментом тонкой соединительной ножкой. Во внутреннем сегменте рядом с ножкой сосредоточено большое количество митохондрий, в нем же располагается ядро клетки. В конце внутреннего сегмента, повернутого к свету, находится синаптический контакт с нервным волокном.
Молекулы родопсина пронизывают липидный бислой мембран зрительных дисков. Для нормальной фоторецепции очень важно, чтобы молекулы пигмента могли совершать быструю латеральную диффузию и находились в очень «мягком» окружении в мембране, так как молекулы пигмента после поглощения фотона претерпевают значительные конформационные перестройки. Низкая вязкость липидного слоя обусловлена очень высоким (до 50%) содержанием полиненасыщенной докозагексеновой жирной кислоты (22 : 6 — она содержит 22 атома углерода и 6 ненасыщенных двойных связей). Однако по этой же причине в липидах мембран могут легко активироваться процессы пероксидного окисления, что, по-видимому, лежит в основе ряда заболеваний глаз.
Зрительный пигмент родопсин — сложный белок. Он состоит из гликопротеидной части — опсина и хромофорной группы — ре-тинальдегида, или просто ретиналя. Ретиналь может иметь несколько пространственных изомеров, например 9-цис-ретиналь, 11-цис-ретиналь, полностью-транс-ретиналь и др. Вся совокупность фотохимических превращений родопсина зиждется на двух фундаментальных явлениях. Во-первых, ретиналь под действием света способен переходить в различные цис-транс-изомеры, наиболее важные из которых (11-цис- и полностью-транс-ретиналь) изображены на рис. 24.27. Во-вторых, только одна из этих изомерных форм, а именно 11-цис-ретиналь, структурно соответствует центру связывания ретиналя на опсине и образует с ним прочный комплекс. Другие изомеры таким соответствием не обладают и комплекс хромофор-белок непрочен.
Единственной фотохимической реакцией, которая приводит к появлению ощущения света, в зрительном рецепторе является фотоизомеризация (см. §24.9) 11-цис-ретиналя в полностью-транс-конформацию. После образования транс-формы пространственное соответствие хромофора и опсина нарушается, а это приводит к целой серии конформационных перестроек в молекуле белка, которые сопровождаются изменениями в спектре поглощения зрительного пигмента. Перестройки родопсина завершаются его распадом на опсин и полностью-яузамс-ретиналь. Далее фермент изомераза переводит полностью-транс-ретиналь в 11-цис-ретиналь, после чего происходит его присоединение к опсину и регенерация родопсина.
 Фотопревращения родопсина приводят к электрическому ответу рецепторной клетки. За этим процессом можно проследить путем регистрации электроретинограмм (экстраклеточного отведения потенциалов от сетчатки). Сразу после освещения палочки короткой вспышкой света наблюдается продолжающийся примерно 1 мс ранний рецепторный потенциал (РРП), амплитуда которого растет с увеличением интенсивности вспышки, но не превышает 5 мВ (рис. 24.28). Затем через 1 мс развивается поздний рецепторный потенциал (ПРП). Обращают на себя внимание несколько особенностей рецепторных потенциалов. Во-первых, в отличие от всех других известных клеток на цитоплазматической мембране наружных сегментов палочек потенциал имеет знак (+) внутри и знак (-) снаружи. Под действием света происходит развитие некоторого подобия потенциала действия нервных клеток, но с противоположным знаком. Во-вторых, индуцированный светом сигнал состоит из двух фаз: РРП и ПРП, природа которых совершенно различна. По-видимому, РРП связан с перемещением молекул родопсина во время конформационных перестроек, вызванных освещением. На молекуле этого белка имеются фиксированные заряды, положение которых относительно бислоя липидов после поглощения квантов света меняется, что и является причиной РРП. Следует подчеркнуть, что в возникновении РРП не участвуют никакие процессы изменения ионной проницаемости мембран. После РРП начинаются процессы совершенно иной природы, в которых решающую роль играет движение ионов через клеточную мембрану.
Фотопревращения родопсина приводят к электрическому ответу рецепторной клетки. За этим процессом можно проследить путем регистрации электроретинограмм (экстраклеточного отведения потенциалов от сетчатки). Сразу после освещения палочки короткой вспышкой света наблюдается продолжающийся примерно 1 мс ранний рецепторный потенциал (РРП), амплитуда которого растет с увеличением интенсивности вспышки, но не превышает 5 мВ (рис. 24.28). Затем через 1 мс развивается поздний рецепторный потенциал (ПРП). Обращают на себя внимание несколько особенностей рецепторных потенциалов. Во-первых, в отличие от всех других известных клеток на цитоплазматической мембране наружных сегментов палочек потенциал имеет знак (+) внутри и знак (-) снаружи. Под действием света происходит развитие некоторого подобия потенциала действия нервных клеток, но с противоположным знаком. Во-вторых, индуцированный светом сигнал состоит из двух фаз: РРП и ПРП, природа которых совершенно различна. По-видимому, РРП связан с перемещением молекул родопсина во время конформационных перестроек, вызванных освещением. На молекуле этого белка имеются фиксированные заряды, положение которых относительно бислоя липидов после поглощения квантов света меняется, что и является причиной РРП. Следует подчеркнуть, что в возникновении РРП не участвуют никакие процессы изменения ионной проницаемости мембран. После РРП начинаются процессы совершенно иной природы, в которых решающую роль играет движение ионов через клеточную мембрану.
Особенностью наружных сегментов палочек сетчатки является то, что в покое (в темноте) их цитоплазматическая мембрана имеет высокую проницаемость для ионов натрия, тогда как в покое мембраны нервных и мышечных клеток имеют высокую проницаемость для ионов калия. Асимметрия распределения ионов в палочке по сравнению с внешней средой такая же, как и для других клеток: внутри мало натрия, но много калия. Ведущую роль в открывании натриевых каналов цитоплазматических мембран палочек играет циклический гуанозинмонофосфат, на свету его концентрация падает. Поэтому после поглощения света родопсином натриевые каналы проницаемости закрываются и главным потенциал-образующим ионом становится калий. В результате развивается поздний рецепторный потенциал со знаком (-) внутри клетки.
При слабом свете максимум чувствительности глаза человека расположен в области около 500 нм, что соответствует максимуму поглощения родопсина, содержащегося в палочках. На ярком свету максимум чувствительности смещается к 550 нм, что соответствует максимуму спектра поглощения пигмента в наиболее  распространенном типе колбочек. Пигмент колбочек содержит тот же самый 11-транс-ретиналь, как и родопсин, но белковая часть пигмента отличается, поэтому пигменты колбочек носят название иодопсинов.
распространенном типе колбочек. Пигмент колбочек содержит тот же самый 11-транс-ретиналь, как и родопсин, но белковая часть пигмента отличается, поэтому пигменты колбочек носят название иодопсинов.
При измерен
Дата добавления: 2015-06-22; просмотров: 5267;
