Поток солнечной радиации, приходящийся на 1 м2 площади границы земной атмосферы, составляет 1350 Вт. Эту величину называют солнечной постоянной. 4 страница
Если взвешенные частицы велики по сравнению с длиной волны, то рассеяние не соответствует закону Рэлея (24.12) — в знаменателе дроби будет стоять X2. Рассеянный свет теряет свою голубизну и становится белее. Так, пыльное небо городов кажется нам белесым в противоположность темно-синему небу чистых морских просторов. 
Направление рассеянного света, степень его поляризации, спектральный состав и т. д. приносят информацию о параметрах, характеризующих межмолекулярное взаимодействие, размерах макромолекул в растворах, частиц в коллоидных растворах, эмульсиях, аэрозолях и т. д. Методы измерения рассеянного света с целью получения такого рода сведений называют нефелометрией, а соответствующие приборы — нефелометрами.
Еще один тип рассеяния света, названный комбинационным рассеянием, был открыт в 1928 г. Г. С. Ландсбергом и Л. И. Мандельштамом в Москве и одновременно Ч. В. Раманом в Индии. Это явление заключается в том, что в спектре рассеяния помимо несмещенной линии, соответствующей частоте падающего света, появляются новые линии, частоты которых n' представляют собой комбинацию частоты падающего света n0 и частот vi(i = 1, 2, ...) колебательных или вращательных переходов рассеивающих молекул:
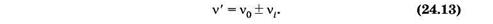
Комбинационное рассеяние можно рассматривать как неупругое соударение квантов с молекулами. При соударении квант может отдать молекуле или получить от нее только такие количества энергии, которые равны разностям двух ее энергетических уровней. Если при столкновении с квантом молекула переходит из состояния с энергией Е' в состояние с энергией Е" (Е" > Е'), то энергия фотона после рассеяния станет равной hv0 - DЕ, где DЕ = Е" - Е'. Соответственно частота кванта уменьшится на n1 = DE/h — возникает спутник с большей длиной волны, который условно называют «красным». Если первоначально молекула находилась в состоянии с энергией Е", она может перейти в результате соударения с фотоном в состояние с энергией Е', отдав избыток энергии DЕ = Е" - Е' кванту. В результате энергия кванта станет равной hvQ + DЕ и частота увеличится на n1 — возникает спутник с меньшей длиной волны, называемый «синим». Рассеяние кванта hv0 может сопровождаться переходами молекулы между различными вращательными или колебательными уровнями Е', Е", Е'" и т. д. В результате возникает ряд симметрично расположенных спутников.
С помощью метода комбинационного рассеяния определяются собственные частоты колебаний молекулы; он позволяет также судить о характере симметрии молекулы. Спектры комбинационного рассеяния настолько характерны для молекул, что с их помощью осуществляется анализ сложных молекулярных смесей. Спектроскопия комбинационного рассеяния дает информацию, аналогичную получаемой инфракрасной спектроскопией, но имеет то преимущество, что позволяет работать с водными растворами молекул, используя видимый свет, для которого растворитель прозрачен.
§ 24.3. Оптические атомные спектры
Атомными спектрами1 называют как спектры испускания, так и спектры поглощения, которые возникают при квантовых переходах между энергетическими уровнями свободных или слабовзаимодействующих атомов.
Электроны в атомах могут находиться в стационарных энергетических состояниях. В этих состояниях атомы не излучают и не поглощают энергии. Энергетические состояния схематически изображают в виде уровней (см., например, рис. 23.11). Число электронов в атоме ограничено, при отсутствии внешних воздействий они заполняют только часть возможных электронных энергетических уровней с наименьшей энергией. Таким образом, оказываются заполненными нижние электронные уровни, тогда как верхние остаются свободными. Состояние атома с возможной минимальной энергией называют основным. Если атом получает энергию (например, при соударении с другими атомами или при поглощении кванта света), то может произойти переход какого-либо электрона с заполненного на более высокий свободный уровень. При этом атом оказывается в электронно-возбужденном состоянии с избыточной энергией.
Поглощение кванта возможно при условии, если его энергия равна разности энергий какого-либо свободного электронного уровня (_Еi) и заполненного (Ek): hv = Ei - Ek, i > k (23.31). Эта формула выражает закон сохранения энергии.
Возбужденные атомы стремятся перейти в состояние с наименьшей энергией. Поэтому происходят спонтанные квантовые переходы Ei -> Ek. Такие переходы могут быть безызлучательными (энергия передается окружающим атомам при столкновениях, вызывая нагрев тела) или излучательными с испусканием квантов света, энергия которых выражается формулой (23.31). Спонтанное излучение определяется в основном внутренними причинами, является случайным событием и имеет вероятностный характер. Обычные источники света испускают в основном спонтанное излучение.
Особо выделяется другой вид излучения, который называется вынужденным, или индуцированным. Оно возникает при взаимодействии кванта с возбужденным атомом и будет рассмотрено в § 24.8.
Наибольший интерес представляют оптические атомные спектры испускания, которые получают от возбужденных атомов. Их возбуждение обычно достигается при электрическом разряде в газе или нагревании вещества пламенем газовых горелок, электрической дугой или искрой.
Атомные спектры в результате квантования энергии электронов и в соответствии с формулой (23.31) состоят из отдельных линий поглощения или испускания. Подробные сведения о спектрах конкретных атомов можно найти в специальных справочниках по спектроскопии. В качестве простого примера рассмотрим спектр атома водорода и водородоподобных ионов.
Из формул (23.24) и (23.31) можно получить формулу для частоты света, излучаемого (поглощаемого) атомом водорода (Z = 1):
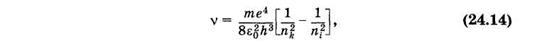
где i и k — порядковые номера уровней, между которыми происходит переход. Эта формула была получена на основании эксперимента И. Я. Бальмером еще задолго до создания квантовой механики и теоретически обоснована Бором (см. § 23.7).
В спектре можно выделить группы линий, называемые спектральными сериями. Каждая серия применительно к спектрам испускания соответствует переходам с различных уровней на один и тот же конечный (рис. 24.5).
В ультрафиолетовой области находятся линии серии Лаймана, которая образуется при переходе с верхних энергетических уровней на самый нижний, основной (nk = 1).
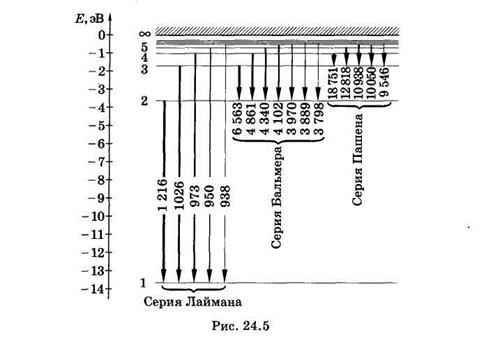
Из формулы (24.14) для серии Лаймана получаем

т. е. находим частоты всех линий этой серии. Самая длинноволновая линия имеет наибольшую интенсивность. Интенсивности спектральных линий на рис. 24.5 условно показаны толщиной линий, отображающих соответствующие переходы.
В видимой и близкой ультрафиолетовой областях спектра расположена серия Баль- мера, которая возникает вследствие переходов с верхних энергетических уровней на второй (nk = 2). Из формулы (24.14) для серии Бальмера получаем
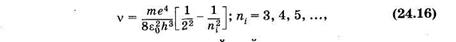
т. е. находим частоты всех линии этой серии.
К инфракрасной области относится серия Пашена, которая возникает при переходах с верхних энергетических уровней на третий (пк = 3). Из формулы (24.14) для серии Пашена следует
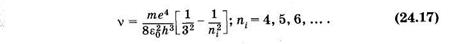
Существуют и другие серии в инфракрасной области. Может показаться, что спектр атомарного водорода не ограничен со стороны малых частот, так как энергетические уровни по мере увеличения га становятся сколь угодно близкими. Однако на самом деле вероятность перехода между такими уровнями столь мала, что практически эти переходы не наблюдаются.
Выражение для работы ионизации атома водорода Аи = hv и потенциала ионизации (12.60) можно получить из (24.14), считая
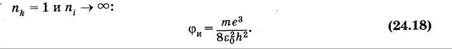
Для атомного спектрального анализа используют как спектры испускания (эмиссионный спектральный анализ), так и спектры поглощения (абсорбционный атомный спектральный анализ). Эмиссионный анализ часто служит для количественного определения микроэлементов в различных образцах, небольшого количества атомов металлов в консервированных продуктах и т. п.
Высокочувствительным и простым методом обнаружения микроколичеств щелочных и щелочноземельных металлов является пламенная фотометрия. Всего этим методом определяют около 50 элементов. Раствор анализируемых веществ распыляют в пламя газовой горелки, где вследствие высокой температуры вещества переходят в парообразное состояние. При этом проводят регистрацию спектров и интенсивности полос поглощения или испускания атомов. Эмиссионный метод обычно обладает большей чувствительностью, чем абсорбционный (см. таблицу 31, где указаны длины волн наиболее интенсивных линий). Так как электронные переходы различных атомов отличаются по длине волны, возможно качественное и количественное определение сразу нескольких элементов в сложных смесях, какими являются многие биологические жидкости.
Таблица 31

1 Атомные спектры называют оптическими, если они лежат в ультрафиолетовом (100—400 нм), видимом (400—760 нм) или инфракрасном (X >760 нм) диапазоне длин волн.
§ 24.4. Молекулярные спектры
Молекулярные спектры (испускания и поглощения) возникают при квантовых переходах молекул с одного энергетического уровня на другой (см. § 23.9) и состоят из совокупности более или менее широких полос, которые представляют собой тесно расположенные линии. Сложность молекулярных спектров по сравнению с атомными обусловлена большим разнообразием движений и, следовательно, энергетических переходов в молекуле.
Учитывая (23.31) и (23.38), находим частоту, излучаемую или поглощаемую молекулой:

здесь один или два штриха относятся к нижнему и верхнему уровням соответственно. Следует иметь в виду, что DЕэл >> DЕК0Л >> DEвр . Если DЕЭЛ = 0 и DЕкол = 0, а DЕвр ¹ 0, то получают состоящие из отдельных линий чисто вращательные молекулярные спектры, которым отвечают [см. (24.18)] невысокие частоты. Такие спектры наблюдаются в далекой инфракрасной и микроволновой (СВЧ) областях.
 Если DЕэл = 0, а DЕКОЛ ¹0, то обычно одновременно и DЕвр¹0, при этом возникает колебательно-вращательный спектр. Он состоит из колебательных полос, распадающихся при достаточном разрешении спектрального прибора на отдельные вращательные линии. На рис. 24.6 графически изображен колебательно-вращательный спектр метана. Колебательно-вращательные спектры наблюдают в близкой инфракрасной области. (Колебательно-вращательные спектры можно также регистрировать методом комбинационного рассеяния, см. § 24.2.)
Если DЕэл = 0, а DЕКОЛ ¹0, то обычно одновременно и DЕвр¹0, при этом возникает колебательно-вращательный спектр. Он состоит из колебательных полос, распадающихся при достаточном разрешении спектрального прибора на отдельные вращательные линии. На рис. 24.6 графически изображен колебательно-вращательный спектр метана. Колебательно-вращательные спектры наблюдают в близкой инфракрасной области. (Колебательно-вращательные спектры можно также регистрировать методом комбинационного рассеяния, см. § 24.2.)
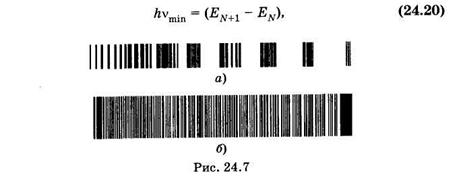
При DЕЭЛ¹0 обычно одновременно DЕкол¹0 и DЕвр¹0. Образуются электронно-колебательные, а точнее — электронно-колебательно-вращательные спектры, которые состоят из различных полос, а полосы — из тесно расположенных линий, соответствующихвращательным переходам. На рис. 24.7, а приведен электронно-колебательный спектр молекулы азота, а на рис. 24.7, б — вращательное расщепление одной из полос.
Электронно-колебательно-вращательные спектры испускания и поглощения наблюдают в видимой и ультрафиолетовой областях.
В сложных многоатомных молекулах с сопряженными двойными связями способность поглощать свет определяется главным образом молекулярными p-орбиталями. При взаимодействии молекулы с квантом света может произойти его поглощение при выполнении условия (23.31) равенства энергии кванта разности энергий какого-либо свободного и заполненного уровней.
Рассмотрим, как протяженность системы сопряженных связей влияет на положение максимума спектра поглощения вещества, т. е. на его окраску.
Вычислим частоту nmin, соответствующую минимальной энергии поглощаемых квантов для электронного перехода с верхнего заполненного на нижний свободный уровень (см. § 23.9)
откуда на основании (23.45) получим:
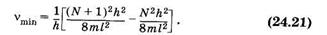
Подставив в (24.21) длину системы сопряженных связей (23.43) l = NL (L — длина одного звена), находим
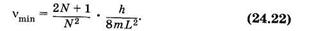
При N ³ 2 первый сомножитель в (24.22) можно принять приближенно равным 2/N, тогда
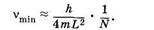
Следовательно, длина волны наиболее длинноволновой полосы поглощения lmах примерно пропорциональна N — числу сопряженных двойных связей в молекуле:
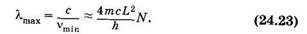
На рис. 24.8 показаны формулы нескольких соединений с сопряженными двойными связями и их спектры поглощения. Видно, что связь между химической структурой молекулы и ее спектральными свойствами, описываемая формулой (24.23), качественно выполняется.
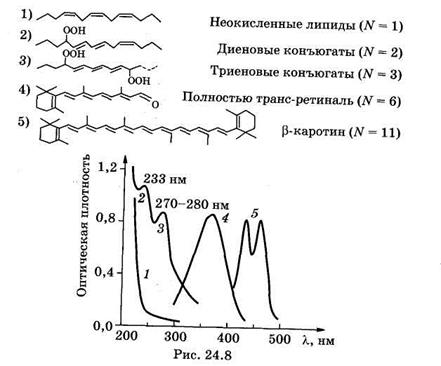
Следует учитывать, что на положение максимума спектра поглощения помимо длины системы сопряженных связей также могут влиять соседние химические группы, агрегатное состояние вещества, растворитель и др. Анализ спектров поглощения дает информацию как о структуре молекул, так и о свойствах среды, окружающей молекулы.
§ 24.5. Различные виды люминесценции
Люминесценцией называют избыточное над тепловым излучение тела, имеющее длительность, значительно превышающую период (-10-15 с) излучаемых световых волн.
Первая часть определения отделяет люминесценцию от равновесного теплового излучения. Люминесценция обычно наблюдается в видимой или ультрафиолетовой областях спектра. Тепловое излучение в этой области возникает только при температуре в несколько сотен или тысяч градусов, тогда как люминесценция наблюдается при любых температурах, поэтому люминесценцию часто называют холодным свечением.
Признак длительности в этом определении был предложен СИ. Вавиловым для того, чтобы отличить люминесценцию от некоторых других явлений вторичного свечения, например отражения и рассеяния света.
Люминесцируют электронно-возбужденные молекулы (атомы). В зависимости от способа возбуждения различают несколько типов люминесценции.
Люминесценция, вызванная заряженными частицами: ионами — ионолюминесценция, электронами — катодолюминесценция, ядерным излучением — радиолюминесценция. Люминесценцию под воздействием рентгеновского и у-излучения называют рентгенолюминесценцией, фотонов видимого света — фотолюминесценцией. При растирании, раздавливании или раскалывании некоторых кристаллов возникает триболюминесценция. Электрическим полем возбуждается электролюминесценция, частным случаем которой является свечение газового разряда. Люминесценцию, сопровождающую экзотермическую химическую реакцию, называют хемилюминесценцией.
§ 24.6. Фотолюминесценция
Фотолюминесценция, называемая иногда просто люминесценцией, подразделяется на флуоресценцию (кратковременное послесвечение) и фосфоресценцию (сравнительно длительное послесвечение).
 Начальным актом любой фотолюминесценции является возбуждение фотоном с энергией hv атома или молекулы. В наиболее простом случае, который обычно реализуется в одноатомных парах и газах при низком давлении, атом возвращается в основное состояние, излучая фотон света той же частоты v (рис. 24.9).
Начальным актом любой фотолюминесценции является возбуждение фотоном с энергией hv атома или молекулы. В наиболее простом случае, который обычно реализуется в одноатомных парах и газах при низком давлении, атом возвращается в основное состояние, излучая фотон света той же частоты v (рис. 24.9).
Это явление называют резонансной флуоресценцией. Специальные опыты показали, что такое свечение возникает приблизительно через 10~8 с после освещения вещества и поэтому не является рассеянием в обычном понимании этого слова.
При повышении давления или добавлении в люминесцирующие пары инородных газов (водород, кислород и др.) резонансная флуоресценция уменьшается, и появляются другие линии флуоресценции. Это обусловлено тем, что возбужденные атомы успевают столкнуться с окружающими атомами или молекулами. В результате возбужденные атомы переходят в основное состояние, а окружающие частицы приобретают дополнительную кинетическую энергию.
Органические молекулы, имеющие систему сопряженных двойных связей, в основном (невозбужденном) состоянии почти все находятся в нижнем колебательном состоянии электронного уровня So (см. рис. 23.16).
Распределение молекул по энергетическим уровням за счет тепловой энергии определяется распределением Больцмана (§ 2.4) 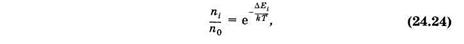
где п0 и ni — число молекул в основном и t-ом возбужденном состояниях, DЕi — разность энергий для этих состояний, k — постоянная Больцмана, Т — абсолютная температура.
Под действием света при выполнении условия (23.31) может произойти возбуждение молекулы с переходом на разные колебательные уровни электронных уровней S1, S2 и т. д. Длина стрелок, направленных вверх (см. рис. 23.16), равна энергии поглощаемых квантов. Поглощение кванта происходит примерно за 10-15 с. В течение последующих –10-12 с возбужденная молекула. отдает часть энергии окружающей среде и переходит на нижний колебательный уровень электронного уровня S1 (безызлучательные переходы показаны направленными вниз волнистыми стрелками). Таким образом, все молекулы, независимо от энергии поглощенного кванта, оказываются в одинаковом самом нижнем возбужденном состоянии, в котором молекула может находиться 10-9—10-8 с. Дальнейшие пути расходования энергии возбуждения могут быть различными.
Часть молекул отдает энергию окружающим частицам, нагревая тело. Это соответствует безызлучательному переходу в основное состояние.
Другая часть излучает кванты флуоресценции, переходя на какой-либо колебательный уровень основного состояния, длина направленных вниз стрелок равна энергии излучаемых квантов.
У части возбужденных молекул происходит обращение спина с переходом в триплетное состояние T1 возвращение из которого на основной уровень So запрещено (маловероятно), поскольку, в соответствии с принципом Паули, в основном состоянии не может быть двух электронов с одинаковыми спинами. Это приводит к задержке молекулы в триплетном состоянии на время от 10-6 до 10 с. Триплетные молекулы из-за большого времени жизни успевают многократно столкнуться с окружающими молекулами, поэтому они с большей вероятностью переходят в основное состояние безызлучательно. Небольшая доля триплетных молекул переходит в основное состояние, излучая кванты фосфоресценции. В жидких растворах фосфоресценцию обычно наблюдать не удается, т. к. почти все триплетные молекулы переходят в основное состояние безызлучательно. Поэтому для наблюдения фосфоресценции растворы замораживают или исследуемое вещество помещают в твердый растворитель.
Каждый из описанных процессов происходит с определенной вероятностью, называемой квантовым выходом. Так, квантовый выход флуоресценции (jфл) равен отношению числа излученных квантов флуоресценции к числу поглощенных квантов или отношению потока флуоресценции (jфл) к потоку поглощенного света I0(1 - T)S, где I0 — интенсивность возбуждающего света, S — площадь поглощающей поверхности, а (1 - Т) — коэффициент поглощения:
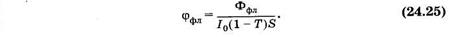
Значения квантового выхода флуоресценции для разных веществ сильно отличаются. Для флуоресцеина (jфл = 0,9, для белков -— варьирует в пределах 0,01—0,03. Флуоресцирующие соединения удается с высокой чувствительностью (до 10-10 г в пробе) обнаруживать в сложных смесях нефлуоресцирующих соединений. По флуоресценции удается обнаруживать грибковые повреждения волос и кожи, следовые количества наркотических веществ, начальные стадии порчи некоторых продуктов.
Из (24.25) следует, что поток флуоресценции (jфл) пропорционален коэффициенту поглощения (1 - Т), который нелинейно зависит от концентрации (см. рис. 24.2, а). Поэтому и флуоресценция зависит от концентрации нелинейно. В эксперименте обычно регистрируют интенсивность флуоресценции Iфл:
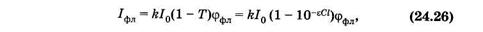
где к — коэффициент, определяемый чувствительностью прибора, Т = 10-eCl, как следует из (24.9). В разбавленных растворах (при оптической плотности D < 0,1) отклонения от линейности составляют менее 5% и ими можно пренебрегать.
Воспользуемся схемой энергетических уровней молекул и переходов между ними (рис. 23.16) для пояснения законов люминесценции.
Дата добавления: 2015-06-22; просмотров: 817;
