Определение скорости кровотока
Существует несколько методов определения скорости кровотока. Рассмотрим физические основы двух из них.
Ультразвуковой метод (ультразвуковая расходеметрия) основан на эффекте Доплера (см. § 5.10). От генератора I электрических колебаний УЗ-частоты (рис. 9.15) сигнал поступает на излучатель 2 и на устройство сравнения частот 3. УЗ-волна 4 проникает в кровеносный сосуд 5 и отражается от движущихся эритроцитов 6. Отраженная УЗ-волна 7 попадает в приемник 8, где преобразуется в электрическое колебание и усиливается. Усиленное электрическое колебание попадает в устройство 3. Здесь сравниваются колебания, соответствующие падающей и отраженной волнам, и выделяется доплеровский сдвиг частоты в виде электрического колебания:
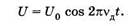
 |
Из формулы (5.65) можно определить скорость эритроцитов:
 |
В крупных сосудах скорость эритроцитов различна в зависимости от их расположения относительно оси: «приосевые» эритроциты движутся с большей скоростью, а «пристеночные» — с меньшей. УЗ-волна может отражаться от разных эритроцитов, поэтому доплеровский сдвиг получается не в виде одной частоты, а как интервал частот. Таким образом, эффект Доплера позволяет определять не только среднюю скорость кровотока, но и скорость движения различных слоев крови.
Электромагнитный метод (электромагнитная расходометрия) измерения скорости кровотока основан на отклонении движущихся зарядов в магнитном поле. Дело в том, что кровь, будучи электрически нейтральной системой, состоит из положительных и отрицательных ионов. Следовательно, движущаяся кровь является потоком заряженных частиц, которые перемещаются со скоростью Укр. На движущийся электрический заряд q в магнитном поле с индукцией В действует сила (см. § 13.3)

Если заряд отрицательный, то сила направлена противоположно векторному произведению vкрх В.
Как показано на рис. 9.16, силы, действующие со стороны магнитного поля на разноименные заряды, направлены в противоположные стороны. Около одной стенки кровеносного сосуда преобладает положительный заряд, около другой — отрицательный.
Перераспределение зарядов по сечению сосуда вызовет появление электрического поля.

 |
Возникающее электрическое напряжение U (см. рис. 9.16) зависит от скорости движения ионов, т. е. от скорости крови [см. (9.19)]. Таким образом, измеряя это напряжение, можно определить и скорость кровотока. Зная сечение S сосуда, нетрудно вычислить объемную скорость кровотока (м3/с):
Практически удобнее в этом методе использовать переменное магнитное поле (рис. 9.17). Это приводит к возникновению переменного напряжения U, котopoe затем усиливается и измеряется.
Р А З Д Е Л 3
Термодинамика. Физические процессы в биологических мембранах
| В |
разделе рассматриваются явления, сущность которых определяется хаотическим движением огромного числа молекул, из которых состоят тела разной природы. Изучая эти явления, применяют два основных метода. Один из них — термодинамический, он исходит из основных опытных законов, получивших название начал (законов, принципов) термодинамики. При таком подходе не учитывается внутреннее строение вещества.
Другой метод — молекулярно-кинетический (статистический) — основан на представлении о молекулярном строении вещества. Учитывая, что число молекул в любом теле очень велико, можно, используя теорию вероятностей, установить определенные закономерности.
В разделе в разной степени используются оба подхода.
Медикам данные вопросы важны для понимания энергетики организма, теплообмена биологических систем с окружающей средой, выяснения физических процессов, происходящих в биологических мембранах, и др.
Г Л А В А 10 Термодинамика
Под термодинамикой понимают раздел физики, рассматривающий тела, между которыми возможен обмен энергией (термодинамические системы), без учета микроскопического строения тел, составляющих систему. Различают термодинамику равновесных систем или систем, переходящих к равновесию (классическая, или равновесная, термодинамика, часто называемая просто термодинамикой), и термодинамику неравновесных систем (неравновесная термодинамика). Неравновесная термодинамика играет особую роль для рассмотрения биологических систем.
В главе наряду с термодинамикой изложены также вопросы, связанные с использованием низких температур и нагретых сред для лечения, а также элементы термометрии и калориметрии.
Основные понятия термодинамики. Первое начало термодинамики
Состояние термодинамической системы характеризуется физическими величинами, называемыми параметрами системы (объем, давление, температура, плотность и т. д.).
Если параметры системы при взаимодействии ее с окружающими телами не изменяются с течением времени, то состояние системы называют стационарным. Примерами таких состояний в течение небольшого отрезка времени являются состояние внутренней части работающего домашнего холодильника, состояние тела Человека, состояние воздуха в отапливаемом помещении и т. д.
В разных частях системы, находящейся в стационарном состоянии, значения параметров обычно различаются: температура в разных участках тела человека, концентрация диффундирующих молекул в разных частях биологической мембраны и т. п. В системе, таким образом, поддерживаются постоянные градиенты некоторых параметров, с постоянной скоростью могут протекать химические реакции.
 |
Стационарное состояние поддерживается за счет потоков энергии и вещества, проходящих через систему. Схематически на рис. 10.1, а показано стационарное состояние, температура неодинакова в разных точках системы. Ясно, что в стационарном состоянии могут находиться такие системы, которые либо обмениваются и энергией, и веществом с окружающими системами (открытые системы), либо обмениваются только энергией (закрытые системы).
Термодинамическая система, которая не обменивается с окружающими телами ни энергией, ни веществом, называется изолированной. Изолированная система со временем приходит в состояние термодинамического равновесия. В этом состоянии, как и в стационарном, параметры системы сохраняются неизменными во времени. Существенно, что в равновесном состоянии параметры, не зависящие от массы или числа частиц (давление, температура и др.), одинаковы в разных частях этой системы.
Естественно, что любая реальная термодинамическая система не будет изолированной хотя бы потому, что ее невозможно окружить оболочкой, не проводящей теплоту. Изолированную систему можно рассматривать как удобную термодинамическую модель. Схематически равновесное состояние изолированной системы показано на рис. 10.1, б.
Рассмотрим подробнее взаимодействие закрытой системы с окружающими телами. Обмен энергией между ними может осуществляться в двух различных процессах при совершении работы и при теплообмене.
Мерой передачи энергии в процессе теплообмена является количество теплоты, а мерой передачи энергии в процессе совершения работы является работа[1][1][1].
 Найдем выражение для вычисления работы, совершаемой газом при изменении его объема. Предположим, что газ, находящийся в цилиндрическом сосуде под поршнем, изобарно расширяется от V1 до V2 (рис. 10.2), при этом поршень перемещается на расстояние ∆l = l2 – l1, а объем изменяется на AV = V2-V1
Найдем выражение для вычисления работы, совершаемой газом при изменении его объема. Предположим, что газ, находящийся в цилиндрическом сосуде под поршнем, изобарно расширяется от V1 до V2 (рис. 10.2), при этом поршень перемещается на расстояние ∆l = l2 – l1, а объем изменяется на AV = V2-V1
На поршень, площадь поперечногосечения которого S, со стороны газа вследствие давления р действует сила F = pS. Так как направление этой силы совпадает с направлением перемещения поршня, то работа, совершаемая газом,
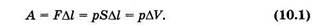
При расширении газа AF > 0 и работа положительна (∆V > 0); при сжатии ∆V < 0 и А < 0. Заметим, что речь идет о работе, совершаемой газом, а не внешними силами. Работа всех внешних сил, наоборот, при расширении газа окажется отрицательной, а при сжатии — положительной.
Если при изменении объема давление газа изменяется, то следует вычислять элементарную работу, соответствующую достаточно малому изменению объема dV:
dA=pdV (10.2)
 |
Проинтегрировав (10.2), получим работу, совершаемую газом:
 |
В качестве примера найдем работу идеального газа при изотермическом процессе. Для этого подставим в формулу (10.3) вместо давления его выражение из уравнения Менделеева — Клапейрона:
 |
Получим
Здесь m — масса газа, М — молярная масса (масса моля), Т — термодинамическая температура, Д = 8,31 Дж/(моль • К) — молярная газовая постоянная.
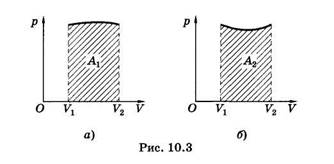
Из уравнения (10.3) ясно, что работа, совершаемая газом, графически определяется как площадь криволинейной трапеции в координатах давление — объем (рис. 10.3). Из рисунка, на котором представлены графики двух различных процессов с одинаковым начальным и конечным состояниями, видно, что работа зависит от процесса. Так, работа А1 (рис. 10.3, а) больше, чем работа А2 (рис. 10.3, б).
 |
Закон сохранения энергии для тепловых процессов формулируется как первое начало термодинамики. Количество теплоты, переданное системе, идет на изменение внутренней энергии системы и совершение системой работы:
Под внутренней энергией системы понимают сумму кинетической и потенциальной энергий частиц, из которых состоит система.
Внутренняя энергия U является функцией состояния системы и для данного состояния имеет вполне определенное значение; ∆U есть разность двух значений внутренней энергии, соответствующих конечному и начальному состояниям системы: ∆U = U2 — U1
Количество теплоты Q, как и работа, является функцией процесса, а не состояния. И количество теплоты, и работу нельзя выразить в виде разности двух значений какого-либо параметра в конечном и начальном состояниях. В связи с этим Q и А в (10.6) записаны без знака приращения ∆.
Для достаточно малых значений Q, А и малых приращений U используют соответственно обозначения δQ, δА и dU, подчеркивая этим отличие понятий количества теплоты и работы от внутренней энергии.
Ради упрощения в дальнейшем используются одинаковые обозначения (dQ, dA и dU), однако следует помнить различие этих
 |
физических величин. С учетом изложенного первое начало термодинамики можно записать в виде:
Значения Q, A, ∆U и dQ, dA, dU могут быть как положительными (теплота передается системе внешними телами, внутренняя энергия увеличивается, газ расширяется), так и отрицательными (теплота отнимается от системы, внутренняя энергия уменьшается, газ сжимается).
Дата добавления: 2015-06-22; просмотров: 961;
