ОПРЕДЕЛЕНИЕ ЭЛЕКТРОХИМИЧЕСКОГО ЭКВИВАЛЕНТА МЕДИ
Вещества, растворы которых в воде и некоторых других диэлектрических жидкостях проводит электрический ток, называют электролитами или проводниками второго рода.
Выясним механизм проводимости водных растворов электролитов на примере раствора поваренной соли NaCI.
Взаимодействие атомов натрия и хлора в молекуле поваренной соли упрощенно можно представить как взаимодействие двух ионов: положительно заряженного иона Na+ и отрицательно заряженного иона CI.- (рис.1). Объясняется это тем, что единственный валентный электрон у натрия слабо связан с атомом. При образовании молекул NaCI. этот электрон переходит к атому хлора, превращая его в отрицательный ион CI.-; в соответствии с этим молекулу NaCI можно схематически изобразить в виде диполя (рис. 2).

Рис.2
При растворении поваренной соли в воде молекулы NaCI попадают в окружение молекул воды, которое тоже являются диполями. В электрическом поле, создаваемом молекулой NaCI , молекулы воды ориентируются так, как показано из рис. 2. При этом они растягивают молекулу NaCI настолько, что незначительная ее встряска при отклонении с другими молекулами разрушает ее. Часть молекул NaCI распадается - диссоциирует на ионы Na+ и CI.-. Этот процесс называется электролитической диссоциацией. Ионы разных знаков при встрече могут снова объединиться в нейтральные молекулы – рекомбинировать.
При неизменных условиях в растворе устанавливается динамическое равновесие, при котором число молекул, распадающихся в единицу времени на ионы, равно числу пар ионов, которые за то же время вновь воссоединяющихся в нейтральные молекулы. Другими словами, в водных растворах электролитов всегда имеются в наличии свободные носители зарядов – положительно и отрицательно заряженные ионы.
Если в сосуд с раствором электролита опустить электроды и включить их в электрическую цепь, то отрицательные ионы начнут двигаться к положительному электроду – аноду, а положительные к отрицательному – катоду. В результате устанавливается электрический ток. Поскольку перенос заряда в водных растворах или расплавах электролитов осуществляется ионами, такую проводимость называют ионной.
При прохождении тока, например, через раствор медного купороса СuSO4 происходит следующий процесс. Положительные ионы Сu++ при соприкосновении с катодом получают недостающие электроны и выделяются на катоде в виде нейтральных атомов. Отрицательные ионы (SO4)- - при соприкосновении с анодом отдают лишние электроны. Появившиеся на аноде электроны по внешней цепи переходят на катод и там соединяются с положительными ионами. Если анод медный, то нейтрализовавшиеся ионы SO4 вступают с ними в химическую реакцию и вновь образуют молекулы медного купороса: SO4 + Сu 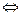 СuSO4
СuSO4 

В результате количество медного купороса в растворе остается неизменным, на катоде выделяется медь, а медь с анода, вступая в химическую реакцию с группой SO4 , переходит в раствор.
Процесс выделения на электродах продуктов разложения электролита при прохождении через этот электролит электрического тока, называется электролизом. Согласно первому закону Фарадея, масса выделивщегося на электроде вещества m пропорциональна силе тока I и времени его прохождения t.
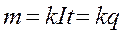 (1)
(1)
где k-коэффициент пропорциональности, а It=q заряд, перенесенный ионами за время t.
Из формулы /1/ видно, что коэффициент k численно равен массе выделившегося на электродах вещества при переносе ионами заряда, равного 1 Кулону. Величину k называют электрохимическим эквивалентом данного вещества. Электрохимический эквивалент выражается в кг/Кл.
Согласно второму закону Фарадея, электрохимический эквивалент вещества пропорционален его химическому эквиваленту 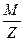 .
.
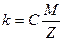 (2)
(2)
где М – молярная масса вещества,
Z – валентность,
С – постоянная величина, одинаковая для всех элементов.
Введя вместо коэффициента С величину, ему обратную, второй закон Фарадея можно переписать в виде :
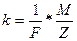 (3)
(3)
где 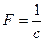 -число Фарадея.
-число Фарадея.
Объединяя формулы /1/и /3/, получим:

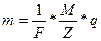
Если масса выделившегося вещества равна его химическому эквиваленту, т. е. /m/=/ 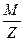 /,то /F/=/q/. Таким образом, число Фарадея F численно равно количеству электричества g, при прохождении которого через электролит на электроде выделяется количество вещества, равное химическому эквиваленту, F=9.6484*104Кл/моль.
/,то /F/=/q/. Таким образом, число Фарадея F численно равно количеству электричества g, при прохождении которого через электролит на электроде выделяется количество вещества, равное химическому эквиваленту, F=9.6484*104Кл/моль.
В настоящей работе требуется определить электрохимический эквивалент меди и число Фарадея.
II. ОПИСАНИЕ ЭКСПЕРИМЕНТАЛЬНОЙ УСИАНОВКИ.
Для определения электрохимических эквивалентов различных веществ пользуются так называемыми вольтметрами. Медный вольтметр состоит из стеклянной банки, в которую налит раствор медного купороса и погружены две пластинки из красной меди, снабженные клеммами для включения их в цепь /см. рис.3/.Электрическое поле между электродами создается с помощью источника тока/аккумулятора, выпрямителя и др./, сила тока регулируется реостатом R и измеряется амперметром А. Цепь замыкается ключом К, время отмечается по часам.
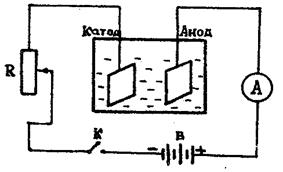
Рис.3
I. Порядок выполнения работы.
1. Зачистите электроды наждачной бумагой, промойте струей воды из под крана и просушите над электроплиткой (электроды должны быть совершенно чистыми).
2. Определите массу одной из пластинок m1 на весах с точностью 0,01 грамма.
3. Соберите схему согласно рис. 3, используя в качестве катода пластинку с известной массой.
4. Замкните цепь ключом К и установите реостатом R силу тока I.
5. Проведите процесс электролиза в течении времени t (сила тока I и время процесса t задается преподавателем).
6. Выньте катодную пластинку, помойте ее струей воды, просушите ее и определите массу m2.
7. Вычислите массу m отложившейся на пластинке меди: m = m2 – m1.
8. Подставляя значения m, I, t в формулу (1), рассчитайте электрохимический эквивалент меди k.
9. Вычислите число Фарадея по формуле: 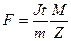 зная, что М = 63,57*10-3 Кл/моль, а z = 2.
зная, что М = 63,57*10-3 Кл/моль, а z = 2.
10. Данные измерений и вычислений занесите в таблицу 1.
11. Сделайте выводы.
Таблица 1
| Масса пластинки m | Масса отложившейся меди, кг | Сила тока, А | Длительность опыта, с | ЭХЭ, кг/Кл | Число Фарадея, Кл/моль | |
| До опыта, г | После опыта, г | |||||
Дата добавления: 2015-06-17; просмотров: 7555;
