ОРГАНИЧЕСКИЕ ВЕЩЕСТВА
Органическими веществами называют сложные углеродсодержащие вещества, количество которых во много раз превосходит количество неорганических соединений. Если в начале XIX в. было известно около 80 органических веществ природного происхождения, то к началу XX в. их число составило уже 100 000, а сейчас число органических соединений, выделенных из природного сырья или полученных синтетически, превышает несколько миллионов и постоянно увеличивается.
Первоначально считалось, что органические вещества синтезируются только живыми организмами и для их образования необходима "жизненная сила". Действительно, все встречающиеся в природе органические вещества входят в состав живых организмов или являются продуктами их жизнедеятельности. Однако химический синтез мочевины показал полную несостоятельность виталистических взглядов на сущность жизни и на природу химических процессов, приводящих к образованию органических веществ.
Большинство органических веществ образовано небольшим количеством элементов. Практически во все эти вещества, помимо углерода, входит водород, многие из них содержат кислород и азот. Эти четыре элемента легко образуют ковалентные связи за счет спаривания электронов на внешних орбиталях атомов. Для полного заполнения внешней орбитали углероду недостает четырех электронов, поэтому он способен образовать четыре общие электронные пары (четыре ковалентные связи), азоту недостает трех электронов, кислороду — двух, а водороду — одного. Углерод, азот и кислород способны, кроме того, образовывать и двойные связи, что значительно увеличивает разнообразие органических веществ и придает им новые свойства. В состав большого числа органических соединений входят также сера, фосфор и галогены.
Входящие в состав живых организмов органические вещества крайне разнообразны по своей структуре и выполняемым функциям. На этих свойствах основана их классификация, хотя в ряде случаев этот принцип строго не соблюдается. Например, в группу витаминов объединены вещества, имеющие разную структуру, химические свойства и обладающие различным биологическим действием, однако все они необходимы животным и человеку в микроколичествах. В состав живых организмов входят не только низкомолекулярные органические вещества (аминокислоты, сахара, органические кислоты, нуклеотиды, липиды и т.д.), но и высокомолекулярные, или биополимеры. Полимерами называют молекулы, состоящие из большого количества повторяющихся единиц — мономеров, соединенных друг с другом ковалентными связями и образующих длинную неразветвленную или разветвленную цепь. Полимер называют гомополимером, если входящие в его состав мономеры одинаковы (например, полисахариды — крахмал, гликоген, целлюлоза, состоящие из молекул глюкозы), или гетерополимером, если он построен из нескольких различающихся "строительных блоков" (белки, построенные из 20 аминокислот, нуклеиновые кислоты, состоящие из нуклеотидов 4 типов).
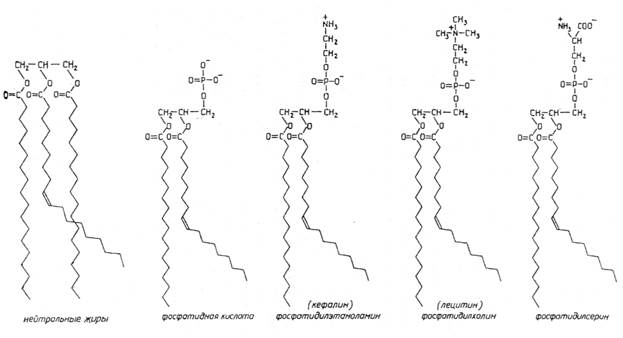
Липиды.Особую группу органических соединений клетки составляют липиды (жиры и жироподобные вещества), имеющие разное строение и выполняющие разнообразные функции. Все они являются гидрофобными соединениями, т.е. нерастворимы в воде, но растворимы в неполярных органических растворителях (хлороформе, бензоле, эфире). Наиболее просто устроены нейтральные липиды, или жиры, которые представляют собой эфиры трехатомного спирта глицерина и жирных кислот (рис.X.12). Если все гидроксильные группы глицерина связаны с жирными кислотами, образуются триглицериды, если две или одна — диглицериды и моноглицериды соответственно.
Входящие в состав нейтральных липидов жирные кислоты содержат, как правило, четное число атомов углерода (от 14 до 22, чаще всего 16 или 18). Если в молекулах жирных кислот имеются одна или несколько двойных связей, они называются ненасыщенными или полиненасыщенными. Ненасыщенные жирные кислоты имеют низкую температуру плавления, поэтому образованные ими липиды жидкие при температуре тела или при температуре окружающей среды (например, растительное масло), тогда как липиды, содержащие насыщенные, т.е. не имеющие двойных связей жирные кислоты, плавятся при более высоких температурах (например, свиное сало, сливочное масло).
|
| Рис.Х.12. Структуры молекул нейтрального жира (триглицерида) и основных представителей фосфолипидов |
Нейтральные жиры могут откладываться в цитоплазме в виде жировых капель; в клетках жировой ткани, например, они заполняют практически все внутреннее пространство. Расщепление жиров до углекислого газа и воды дает большое количество энергии (38,9 кДж/r), этим обусловлена энергетическая функция жиров. Освобождаемое при их окислении большое количество воды (при "сгорании" 1 г жира освобождается 1,1 г воды) используется организмами, именно поэтому животные пустынь (верблюды) или впадающие в зимнюю спячку (сурки, суслики) могут длительное время обходиться без воды, используя свои жировые запасы. Таким образом, жиры могут быть источником воды. У животных нейтральные жиры откладываются в основном в подкожной клетчатке, где создают хороший теплоизоляционный слой, особенно развитый у морских млекопитающих — китообразных и ластоногих (теплоизоляционная функция). Откладываясь в полости тела вокруг внутренних органов, жировая подушка защищает их от механических повреждений при движении, прыжках, ударах и т.д. (защитная функция жиров). В небольших количествах нейтральные жиры входят в состав биологических мембран, выполняя тем самым структурную функцию.
Однако основу биологических мембран составляют не нейтральные жиры, а фосфолипиды. Они также представляют собой эфиры глицерина и жирных кислот, но с жирными кислотами в молекуле глицерина связаны только две спиртовые группы, а третья образует эфирную связь с остатком фосфорной кислоты (см. рис.Х.12). Фосфорная кислота может образовывать дополнительную эфирную связь с низкомолекулярными спиртами, формируя различные классы фосфолипидов.
Если в состав фосфолипида входит аминоспирт холин, образуется фосфатидилхолин (лецитин), если аминоспирт этаноламин — фосфатидилэтаноламин (кефалин), если аминокислота серии — фосфатидилсерин и т.д.
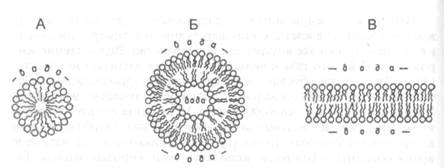
Таким образом, в составе молекул всех фосфолипидов имеются гидрофобная (остатки жирных кислот) и гидрофильная (фосфорная кислота и присоединенный к ней спирт) компоненты, и поэтому молекулы могут контактировать как с полярными, так и с неполярными растворителями (такие вещества называют амфифильными). В воде и водных растворах фосфолипиды самопроизвольно формируют мицеллы, или капли, в которых жирнокислотные "хвосты" обращены внутрь, а полярные "головки" — в раствор, липосомы — двухслойные фосфолипидные везикулы, внутренний объем которых заполнен водой, или протяженные плоские бислойные структуры — основу всех биологических мембран (рис.Х.13). Такие мембраны окружают все клетки, создавая гидрофобный барьер между внутриклеточным содержимым и наружной средой; мембраны клеточных органоидов отделяют их содержимое от цитоплазмы и разделяют клетку на отсеки — компартменты. Мембраны плохо проницаемы для воды и полярных соединений (солей, аминокислот, Сахаров), но проницаемы для гидрофобных веществ.
|
| Рис.X. 13. Схематическое изображение мицеллы (А), липосомы (Б) и фосфолипидного бислоя (В), образуемых фосфолипидами в водном окружении |
В состав мембран входят различные белки, как интегральные, так и периферические (см. рис.Х.3), которые обеспечивают избирательную проницаемость мембран для различных веществ, иногда затрачивая на это энергию АТФ (ионные насосы, ионные каналы, белки-переносчики, рецепторы гормонов и т.д.). Поскольку в состав фосфолипидов входит большое количество ненасыщенных и полиненасыщенных жирных кислот, биологические мембраны при температуре обитания живых организмов находятся в "полужидком" (жидкокристаллическом) состоянии, что обеспечивает их гибкость, упругость и высокую подвижность встроенных в них белков. Итак, основной функцией фосфолипидов является формирование биологических мембран (строительная функция).
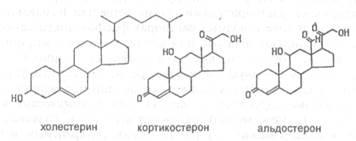
Особое место среди липидов занимают стероиды — полициклический спирт холестерин и его производные (рис.X.14). Холестерин и его эфиры с жирными кислотами входят в состав биологических мембран, придавая им определенную "жесткость" (структурная функция). Кроме того, в корковом слое надпочечников из холестерина образуются стероидные гормоны (минералкортикоиды и глюкокортикоиды), регулирующие водно-солевой и углеводный обмен, а в половых железах — половые гормоны (мужские — андрогены и женские — эстрогены).
|
| Рис.X. 14. Структура холестерина и его производных — гормонов коркового слоя коры надпочечников |
В клетках печени из холестерина образуются желчные кислоты (холевая, дезоксихолевая и др.), необходимые для нормального переваривания жиров в кишечном тракте. Эти кислоты являются поверхностноактивными веществами и способны эмульгировать жировые капли. Кроме того, они активируют липазы — ферменты, расщепляющие жиры и выделяемые в двенадцатиперстную кишку поджелудочной железой. Таким образом, производные холестерина выполняют регуляторную функцию.
Нарушения в обмене холестерина вызывают тяжелое заболевание — атеросклероз, при котором холестерин может откладываться на стенках кровеносных сосудов в виде "холестериновых бляшек", сужая просвет сосудов и нарушая кровоснабжение органов и тканей, что приводит к развитию ишемии (недостаточное снабжение кислородом) мозга и сердца и, в конечном итоге, к инсульту (поражение мозга) или инфаркту миокарда. Следует помнить, что развитие атеросклероза провоцируется не только неправильным питанием, но и курением или употреблением спиртных напитков.
К липидам относятся воска — эфиры жирных кислот и многоатомных спиртов. У животных они вырабатываются кожными железами. Покрывая тонким слоем шерсть и перья, воска предохраняют их от намокания. Некоторые насекомые (пчелы) используют воска для постройки сотов. У растений воска создают защитный налет на листьях и плодах. Много восков вырабатывают также морские планктонные микроорганизмы.
К липидам относят жирорастворимые витамины — A, D, Е, обладающие высокой биологической активностью.
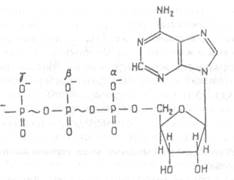
Нуклеотиды (АТФ и НАД+). АТФ (аденозинтрифосфорная кислота) представляет собой мононуклеотид и, как все нуклеотиды, состоит из азотистого основания (аденина), пятиуглеродного сахара рибозы и остатков (в данном случае трех) фосфорной кислоты (рис.Х.15). Гидролиз молекулы АТФ, осуществляемый специальными ферментами — АТФазами, приводит к отщеплению от ее молекулы одного остатка фосфорной кислоты и к образованию АДФ (аденозиндифосфорной кислоты). Эта реакция сопровождается выделением значительного количества энергии (около 40 кДж/моль). Такие связи, гидролиз которых сопровождается значительным выделением энергии, называются макроэргическими. В молекуле АТФ две макроэргические связи — между первым и вторым и между вторым и третьим остатками фосфорной кислоты, поэтому отщепление от АТФ двух остатков фосфорной кислоты (пирофосфата) с образованием АМФ (аденозинмонофосфорной кислоты) будет также сопровождаться выделением энергии.
|
| Рис.Х.15. Структура молекулы АТФ. Волнистые линии показывают богатые энергией (макроэргические) связи между 1 и 2 (α и β) и 2 и 3 (β и γ) остатками фосфорной кислоты, разрыв которых с отщеплением пирофосфата и фосфата соответственно сопровождается выделением энергии |
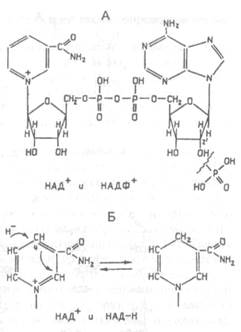
|
| Рис.Х.16. Структура молекулы динуклеотидов НАД+ и НАДФ+. Показано присоединение дополнительной фосфатной группы к остатку рибозы в молекуле НАДФ+ (А). Изменение структуры остатка амида никотиновой кислоты при присоединении к нему двух электронов и протона (аниона Н-)(Б) |
АТФ является универсальным аккумулятором энергии, энергетической "валютой" в клетках живых организмов. Процессы, сопровождающиеся выделением энергии, живые организмы "научились" сопрягать с синтезом АТФ из АДФ и неорганического фосфата (субстратное фосфорилирование в ходе гликолиза и брожения, окислительное фосфорилирование в митохондриях, фотофосфорилирование в хлоропластах растений). В свою очередь, все процессы, протекающие с потреблением энергии, сопровождаются гидролизом АТФ до АДФ и неорганического фосфата (или до АМФ и пирофосфата). Освобождаемая при этом энергия используется клетками для совершения механической работы (АТФаза актомиозина обеспечивает мышечное сокращение), для транспорта через биологические мембраны ионов натрия, калия или кальция против градиента их концентрации (№+,К+-АТФаза и Са2+-АТФаза), а также для различных процессов биосинтеза.
Кроме АТФ, в клетках присутствуют и другие нуклеотиды, отличающиеся от АТФ структурой азотистого основания: ГТФ (гуанозинтрифосфорная кислота), УТФ (уридинтрифосфорная кислота), ЦТФ (цитидинтрифосфорная кислота). Это также макроэргические соединения, энергия гидролиза которых используется, например, при синтезе белка (ГТФ), полисахаридов (УТФ), фосфолипидов (ЦТФ). Все перечисленные нуклеотиды необходимы для синтеза РНК (рибонуклеиновой кислоты). Дезок-сирибонуклеотиды, содержащие в своем составе пятиуглеродный сахар дезоксирибозу вместо рибозы — дезокси-АТФ, дезокси-ГТФ, дезокси-ЦТФ и дезокси-ТТФ (дезокситимидинтрифосфорная кислота), являются структурными компонентами ДНК (дезоксирибонуклеиновой кислоты).
Помимо мононуклеотидов, важную роль в обмене веществ играют динуклеотиды, в первую очередь НАД+ (никотинамидаде-ниндинуклеотид) и НАДФ+ (никотинамидадениндинуклеотидфосфат), имеющие в своем составе два азотистых основания (аденин и амид никотиновой кислоты — производное витамина РР), два остатка рибозы и два остатка фосфорной кислоты (рис.X.16).
Если АТФ является в клетке универсальным источником энергии, то НАД+ и НАДФ+ — универсальные акцепторы, а их восстановленные формы — НАДН и НАДФН — универсальные доноры восстановительных эквивалентов (атомов водорода, или, точнее, двух электронов и одного протона) в большинстве окислительно-восстановительных реакций (рис.Х.16).
Входящий в состав остатка амида никотиновой кислоты атом азота четырехвалентен и несет положительный заряд (именно поэтому в аббревиатуре НАД+ используют значок "+"); это азотистое основание в составе молекулы НАД+ легко присоединяет два электрона и один протон (т.е. восстанавливается) в тех реакциях, в которых от субстрата при окислении под действием ферментов дегидрогеназ отрываются два атома водорода (второй протон уходит в раствор):
субстрат-Н2 + НАД+ → субстрат + НАДН + Н+.
В обратных реакциях ферменты, окисляя НАДН или НАДФН, восстанавливают субстраты, присоединяя к ним два атома водорода (второй протон приходит из раствора).
Итак, окисление различных субстратов в процессе энергетического обмена приводит к накоплению восстановительных эквивалентов в виде НАДН (реакции цикла Кребса, окисление жирных кислот и т.д.). НАДН может использоваться в различных реакциях биосинтеза, а также окисляться в дыхательной цепи митохондрий; освобождаемая при этом энергия запасается в виде АТФ. НАДФН образуется в основном при окислительном расщеплении углеводов, а у растений — при фотосинтезе, и также используется либо для синтетических процессов, либо для получения энергии вдыхательной цепи митохондрий.
Кроме никотиновых нуклеотидов, кофакторами многих дегидрогеназ могут быть также флавиновые нуклеотиды — флавинадениндинуклеотид (ФАД) и флавинмононуклеотид (ФМН), которые являются производными витамина В2 (рибофлавина). В отличие от НАД+ и НАДФ+, они присоединяют два атома водорода — два протона и два электрона. Их окисление в дыхательной цепи митохондрий также сопровождается выделением энергии, запасаемой в виде АТФ.
Углеводы. Углеводами (сахарами, сахаридами) называют органические соединения с общей формулой (СН2О)п. По химической природе это чаще всего альдегидоспирты или кетоспирты. В зависимости от числа входящих в молекулу Сахаров углеродных атомов (3, 4, 5, 6 и т.д.) их подразделяют на триозы, тетрозы, пентозы, гексозы и т.д. В живых организмах присутствуют как моносахариды, так и ди- и полисахариды.
Среди моносахаридов наибольшее значение имеют пентозы: рибоза и дезоксирибоза, входящие в состав нуклеотидов, РНК и ДНК, рибулоза, играющая важную роль в процессе фиксации углекислого газа в ходе фотосинтеза, а также гексозы: глюкоза — основной источник энергии у человека и многих животных, фруктоза и галактоза, содержащиеся соответственно в продуктах растительного происхождения и молоке млекопитающих (рис.X. 17). Триозы и тетрозы (глицериновый альдегид и др.) образуются в качестве промежуточных продуктов в различных процессах обмена веществ. Из дисахаридов наиболее распространены сахароза (фруктовый сахар), состоящая из молекул глюкозы и фруктозы, и лактоза (молочный сахар), состоящая из молекул глюкозы и галактозы (рис.Х.17).
Полисахариды представляют собой, как правило, гомополимеры, состоящие из повторяющихся мономеров — молекул глюкозы, соединенных ковалентной связью между 1 и 4 (а у разветвленных полисахаридов — также 1 и 6) атомами углерода. Линейный полисахарид целлюлоза (клетчатка) образует стенки растительных клеток (рис.Х.18). В ней молекулы глюкозы соединены β-1,4-связью, для расщепления которой нужны специальные ферменты.
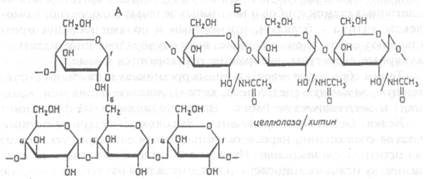
|
| Рис.Х.18. Участок молекулы полисахаридов крахмала и гликогена (А). Показано место присоединения к линейной цепи, в которой молекулы глюкозы соединены α-1,4-связью, бокового ответвления за счет образования 1,6-связи. Участок молекулы полисахаридов целлюлозы и хитина (Б). Мономеры (глюкоза и N- ацетилглюкозамин соответственно) в этих полимера соединены β-1,4-связями |
Целлюлозу могут расщеплять многие бактерии, грибы, одноклеточные микроорганизмы, поэтому они играют главную роль в разложении растительных остатков. Некоторые из этих бактерий и микроорганизмов обитают в сычуге жвачных животных, позволяя им усваивать целлюлозу. В желудке и кишечнике других животных и человека нет ферментов, расщепляющих целлюлозу, поэтому пища, содержащая клетчатку, у них полностью не усваивается.
Основной растительный полисахарид крахмал и основной полисахарид грибов и животных гликоген — разветвленные полимеры, близкие по структуре (гликоген имеет более разветвленную структуру) (см. рис.Х.18). Молекулы глюкозы в них соединены ос-1,4-связью, которая легко расщепляется пищеварительными ферментами животных — амилазами. Образующаяся при расщеплении этих полисахаридов глюкоза всасывается в кишечнике и поступает в кровь. С кровью она разносится по организму и проникает в клетки, где либо используется для получения энергии (в процессе гликолиза), либо откладывается в запас в виде гликогена. У растений основным запасным полисахаридом является крахмал. Расщепление глюкозы в анаэробных условиях (в ходе гликолиза или брожения) или полное аэробное окисление в митохондриях сопровождается выделением большого количества энергии (17,6 кДж/г). Такие же процессы происходят и в организме человека, поэтому в его рационе углеводы занимают значительное место. Их утилизация практически полностью покрывает энергозатраты организма.
К полисахаридам относится хитин — линейный полимер, состоящий из остатков N-ацетил-D-глюкозамина, соединенных β-1,4-связью (см. рис.Х.18). Хитин выполняет структурную и защитную функции. Он образует основу наружного скелета членистоногих и ряда других беспозвоночных, а также входит в состав клеточных стенок грибов и некоторых зеленых водорослей. Комплексы хитина с белками, пигментами и солями кальция представляют собой очень прочные, высокоупорядоченные надмолекулярные структуры, которые не растворяются в воде.
Таким образом, углеводы в живых организмах выполняют структурную, защитную (целлюлоза, хитин), запасную (гликоген, крахмал) и энергетическую (моно-, ди- и полисахариды) функции.
Белки. Белки, или протеины.— высокомолекулярные органические соединения, неразветвленные гетерополимеры, состоящие из остатков аминокислот. Название "белок" было впервые дано веществу птичьих яиц, свертывающемуся при нагревании в белую нерастворимую массу. Позднее этот термин был распространен на другие вещества с подобными свойствами, выделенные из животных и растений. С середины XIX в. белки стали называть "протеинами" (от protos — первый, главный), подчеркнув важность этих веществ для жизни.
Белки построены из 20 различных a-L-аминокислот, соединенных пептидной связью (-CO-NH-) (рис.Х.19). Аминокислоты, входящие в состав белков, называют протеиногенными. Огромное разнообразие белков определяется последовательностью входящих в них аминокислотных остатков и длиной полипептидной цепи. От них зависят различия пространственной структуры, химических и физических свойств белков. В настоящее время общее число белков, встречающихся у всех видов живых организмов, определяется величиной порядка 1010—1012. В состав одной белковой цепи может входить от -50 до -5000 аминокислот (молекулярная масса отдельных полипептидных цепей белков, которые называются субъединицами, составляет, таким образом, от -5 до -550 тысяч дальтон, а молекулярная масса белковых комплексов, состоящих из нескольких субъединиц, может достигать нескольких миллионов дальтон). Белки, содержащие менее 50 аминокислотных остатков, называют пептидами (к ним относятся многие антибиотики, токсины, гормоны), а более крупные — полипептидами (такое деление в известной степени условно).
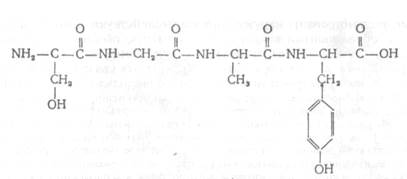
|
| Рис.Х.19. Структура трипептида, состоящего из аминокислот серина, аланина и тирозина, соединенных пептидными связями |
Входящие в состав белков аминокислоты, помимо карбоксильной и аминогруппы, имеют различные боковые радикалы, которые могут быть заряжены отрицательно (дикарбоновые глутаминовая и аспарагиновая аминокислоты) или положительно (гис-тидин, лизин, аргинин, имеющие дополнительные амино- или иминогруппы), содержат атомы серы (цистеин и метионин), гид-роксильные группы (серии, треонин, тирозин), ароматические кольца или гетероциклы (фенилаланин, тирозин, триптофан), могут быть гидрофобными (валин, лейцин, изолейцин) и т.д. Поэтому свойства белков будут определяться составом входящих в них аминокислот: белки могут быть щелочными или кислыми, гидрофобными или гидрофильными, т.е. плохо или хорошо растворимыми в воде. Как правило, гидрофобные аминокислотные радикалы расположены внутри белковых молекул, а гидрофильные экспонированы наружу: они взаимодействуют с молекулами воды, образующими вокруг белка гидратную оболочку. Боковые радикалы аминокислот участвуют в поддержании нативной структуры белков за счет образования водородных связей друг с другом, а также электростатических и гидрофобных взаимодействий.
В живых организмах встречается не 20 аминокислот, входящих в состав белков (их называют протеиногенными), а гораздо больше — около 100. Многие из них выполняют в клетках очень важные функции, так как являются компонентами различных биологически активных соединений и участвуют в обменных процессах. Так, в синтезе мочевины задействованы аминокислоты орнитин и цитруллин, не встречающиеся в белках, а также протеиногенные аминокислоты аргинин и аспарагиновая кислота. Из аминокислот образуются многие гормоны и нейромедиаторы: из тирозина синтезируются катехоламины — гормоны мозгового слоя надпочечников (адреналин, норадреналин), гормоны щитовидной железы (тироксин, трийодтиронин) и пигмент меланин, из триптофана — серотонин, а глутаминовая кислота сама выступает в роли нейромедиатора в мозге. Помимо α-аминокислот в клетках встречаются β- и γ-аминокислоты, в которых аминогруппа присоединена не к первому, а ко второму или третьему атомам углерода. Так, например, β-аланин входит в состав кофермента А, а γ-аминомасляная кислота является нейромедиатором.
Имеется 4 уровня структурной организации белков: первичная структура (последовательность аминокислотных остатков в полипептидной цепи; поддерживается ковалентными пептидными связями) (см. рис.X.19), вторичная структура (α-спиральные участки и β-структурные образования; поддерживается за счет водородных связей между СО- и NH-группами, участвующими в образовании пептидных связей) (рис.Х.20), третичная структура (трехмерная пространственная укладка полипептидной цепи; поддерживается за счет S-S-мостиков между остатками цистеина, гидрофобных, электростатических и водородных связей между аминокислотными остатками) (рис.Х.21) и четвертичная структура (ассоциация нескольких полипептидных цепей в единую структуру). Четвертичную структуру имеют не все белки. Иногда различные белки образуют сложные надмолекулярные комплексы, функционирующие как единое целое (например, рибосомы или компоненты дыхательной цепи митохондрий).
Впервые первичная структура белка — гормона поджелудочной железы инсулина — была расшифрована в 1945—1956 гг. английским ученым Ф.Сангером и его сотрудниками, за что он в 1958 г. был удостоен Нобелевской премии. В настоящее время известна первичная структура многих белков благодаря развитию методов генетической инженерии. Структуру белка определяют по последовательности азотистых оснований в соответствующей кДНК (ДНК-копия, получаемая путем матричного синтеза на иРНК с помощью фермента обратной транскриптазы) или в кодирующих участках гена, что значительно облегчает и ускоряет работу ученых. Вторичную и третичную структуру белков исследуют с помощью достаточно сложных физических методов. Первичная структура белка определяет его вторичную и третичную структуры, т.е. белки способны к самосборке. Однако сейчас установлено, что за правильную сборку и укладку полипептидной цепи белков отвечают специальные белки — шапероны.
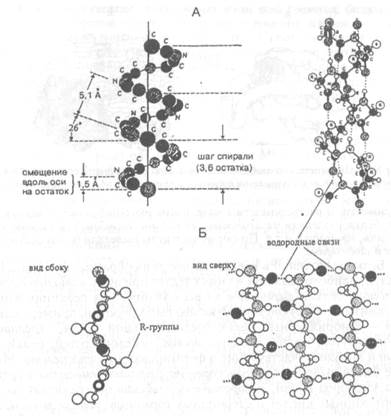
|
| Рис.Х.20. Схематическое изображение правозакрученной α-спирали (А) и β-структуры (Б). Точками показаны водородные связи, участвующие в поддержании вторичной структуры молекулы белка |
Первичная структура белка наиболее устойчива, тогда как остальные легко разрушаются при действии высоких температур, изменении рН, ионной силы и т.п. Такой процесс, приводящий к потере биологических свойств белка, называется денатурацией. Она может быть обратимой или необратимой, в зависимости от силы воздействия и глубины нарушения нативной структуры белка. Разрушение первичной структуры белка, т.е. разрыв его полипептидной цепи на несколько частей, называется деградацией.
Единой классификации белков не существует, хотя попытки создать её предпринимались с конца XIX в. По составу белки разделяли на простые — протеины, состоящие только из аминокислот, и сложные — протеиды, в состав которых входят кроме аминокислот углеводы (гликопротеиды), липиды (липопротеиды), нуклеотиды или нуклеиновые кислоты (нуклеопротеиды), а также металлопротеиды, фосфопротеиды и т.д. В зависимости от растворимости в воде, растворах солей, кислот, щелочей и т.п. белки разделяли на альбумины, глобулины, гистоны, протамины, глютелины, проламины и т.д. По форме молекулы выделяли белки фибриллярные и глобулярные.
|
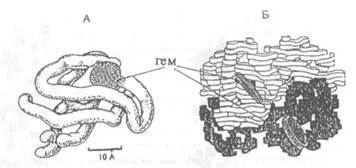
| Рис.Х.21. Схематическое изображение третичной структуры белка миоглобина (А) и четвертичной структуры гемоглобина, состоящего из четырех субъединиц (Б) |
Белки выполняют в клетках самые разнообразные функции. Пожалуй, наиболее важной из них следует признать каталитическую функцию белков-ферментов во всех химических реакциях живых организмов. Структурную функцию выполняют, например, коллаген — фибриллярный белок соединительной ткани, кератин — белок когтей, ногтей и волос, оссеин — белок костей, белки актин и тубулин, участвующие в формировании цитоскелета. Многие белки выполняют транспортную функцию: гемоглобин переносит кислород крови, сывороточный альбумин обеспечивает транспорт жирных кислот и стероидных гормонов, ионные насосы, каналы и переносчики — транспорт различных веществ через биологические мембраны. Гормоны белковой и пептидной природы выполняют регуляторную функцию (гормон поджелудочной железы инсулин, регулирующий поступление глюкозы в клетки, гормон роста и ряд других). Антитела (иммуноглобулины), узнающие и обезвреживающие чужеродные белки, фибриноген, обеспечивающий свертываемость крови, внутриклеточный белок интерферон, подавляющий развитие вирусов, токсины бактерий, растений и животных являются примерами белков с защитной функцией. К белкам, выполняющим запасную или питательную функцию, можно отнести белок молока казеин, альбумин яиц птиц и рептилий, клейковину семян пшеницы, зеин семян кукурузы и т.д. Двигательную функцию выполняют белки миозин и актин, обеспечивающие мышечное сокращение, белки жгутиков и ресничек. Расщепление белков и утилизация аминокислот в процессе энергетического обмена сопровождаются освобождением энергии и ее запасанием в виде АТФ — энергетическая функция.
Белки входят в состав всех живых организмов (растений, животных, бактерий, вирусов) и составляют до 50% сухого веса клеток. Каждый организм синтезирует свои собственные белки, их состав и количество могут изменяться в течение жизни. Белки в организме постоянно обновляются, это их свойство лежит в основе обмена веществ (метаболизма). Синтез белков протекает на рибосомах с участием разных типов РНК. Информация о последовательности аминокислот в каждом индивидуальном белке хранится в ДНК в виде определенной последовательности нуклеотидов в гене.
Белки являются одним из важнейших компонентов пищи человека и животных и не могут быть заменены другими соединениями, так как содержат ряд незаменимых аминокислот, способность к синтезу которых была утрачена человеком и животными в процессе эволюции. Их отсутствие в пище приводит к тяжелым нарушениям азотистого обмена. В процессе пищеварения белки расщепляются до свободных аминокислот, которые всасываются в кишечнике и включаются в метаболизм. Они могут распадаться до простых соединений для получения клетками энергии, а могут идти на синтез белков, присущих данному организму.
Ферменты. Ферментами называют белки, осуществляющие каталитическую функцию. С их участием скорость химических реакций в организме возрастает в миллионы раз. Ферменты как катализаторы обладают рядом уникальных свойств. Во-первых, они ускоряют протекание реакций при очень низких (с точки зрения химии) температурах: 37-40°С — у теплокровных животных и от 0°С — у беспозвоночных и холоднокровных организмов арктических морей, до 70°С — у организмов, обитающих в горячих источниках. Во-вторых, они работают при нейтральных значениях рН. В третьих, ферменты обладают высокой субстратной специфичностью, т.е. взаимодействуют только с одним веществом (субстратом) и ускоряют одну определенную реакцию. Это связано с тем, что в процессе катализа субстрат связывается в определенном участке молекулы фермента — в активном центре, структура которого строго соответствует структуре субстрата.
В активном центре находятся боковые радикалы аминокислот, которые могут располагаться в самых разных участках полипептидной цепи, т.е. вся огромная молекула фермента при формировании третичной или четвертичной структуры укладывается таким образом, чтобы нужные для формирования активного центра аминокислотные радикалы оказались в строго определенном месте, на определенном расстоянии друг от друга. Этим достигается полное соответствие структуры субстрата структуре активного центра, которые "подходят" друг к другу как "ключ к замку". Поэтому размеры молекул ферментов, как правило, во много раз превышают размеры их субстратов.
При связывании в активном центре субстрат взаимодействует с белком за счет электростатических или гидрофобных взаимодействий, которые так изменяют структуру субстрата, что он легко разрывается на две части или присоединяет к себе другой субстрат, легко окисляется или восстанавливается и т.п.Часто ферменты, помимо белковой части, содержат одно из низкомолекулярных соединений небелковой природы — кофермент, или кофактор (обычно он слабо связан с белковой частью фермента и может легко диссоциировать), или простетическую группу (обычно она ковалентно связана с полипептидной цепью фермента). Эти соединения непосредственно участвуют в процессе катализа. Например, ферменты, катализирующие окислительно-восстановительные реакции, часто содержат в качестве кофактора НАД+, ФАД или ионы металлов переменной валентности (железо, медь). Многие кофакторы являются производными витаминов.
Молекулы ферментов часто содержат один или несколько регуляторных центров (помимо активного центра), с которыми могут взаимодействовать различные биологически активные вещества или промежуточные продукты обмена веществ. Такое взаимодействие ускоряет или, наоборот, замедляет протекание катализируемой ферментом реакции. Этим достигается тонкая регуляция метаболизма в живых клетках. Изменение пространственной структуры ферментов при денатурации приводит к полной потере ими каталитической активности.
Нуклеиновые кислоты. Нуклеиновые кислоты выступают в клетках в роли носителей генетической информации и обеспечивают ее реализацию в процессе жизнедеятельности организмов. Они представляют собой линейные гетерополимеры, состоящие из повторяющихся строительных блоков — мономеров, называемых нуклеотидами. Каждый нуклеотид состоит в свою очередь из азотистого основания, сахара пентозы и остатка фосфорной кислоты. Во всех живых клетках присутствуют два типа нуклеиновых кислот — дезоксирибонуклеиновая кислота (ДНК) и рибонуклеиновая кислота (РНК), и только вирусы содержат лишь один из типов нуклеиновых кислот (либо ДНК, либо РНК) (рис.Х.22).
|
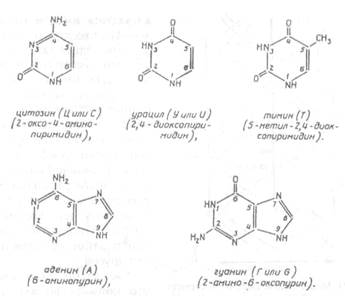
| Рис.X.22. Структура главных пиримидиновых и пуриновых оснований, входящих в состав ДНК и РНК |
Молекула ДНК состоит из нуклеотидов, каждый из которых содержит одно из четырех азотистых оснований — аденин (А), гуанин (Г, или G), тимин (Т) или цитозин (Ц, или С), пятиуглеродный сахар дезоксирибозу и остаток фосфорной кислоты (рис.Х.23).
Аденин и гуанин относятся к производным пурина и содержат два сопряженных гетероциклических кольца (пяти- и шестичленное), а тимин и цитозин — к производным пиримидина, и содержат одно шестичленное гетероциклическое кольцо.
У прокариот обычно имеется одна кольцевая молекула ДНК (кольцевая хромосома), расположенная в цитоплазме, а также небольшие кольцевые молекулы ДНК, называемые плазмидами. У эукариот ДНК сосредоточена в основном в ядре, где она входит в состав хромосом, а также в органоидах, имеющих свой собственный генетический аппарат и аппарат для синтеза белка — в митохондриях и пластидах. Молекулярная масса ДНК очень велика, даже у прокариот она составляет несколько миллиардов дальтон.
|
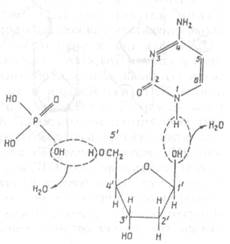
| Рис. Х.23. Схема образования мононуклеотида (на примере дезоксиридина) из урацила, дезоксирибозы и фосфорной кислоты |
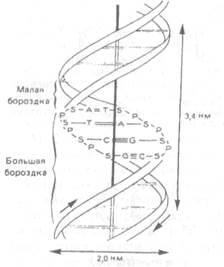
Структурная организация молекулы ДНК была расшифрована в 1953 г. Дж.Уотсоном и Ф.Криком, получившими за это открытие Нобелевскую премию. Молекула ДНК состоит из двух нитей, расположенных параллельно друг другу и формирующих правозакрученную двойную спираль (рис.X.24). Ширина спирали — около 2 нм, а длина может достигать нескольких сотен тысяч нанометров.
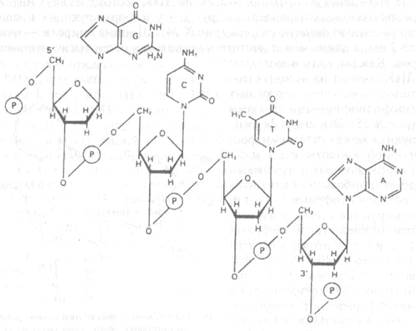
Каждая нить в молекуле ДНК состоит из мононуклеотидов, ковалентно связанных фосфодиэфирными связями (рис.X.25). Эти связи формируются между остатками фосфорной кислоты и 3'- и 5'-гидроксильными группами дезоксирибозы соседних нуклеотидов (цифрами 1, 2 и т.д. нумеруются атомы в азотистом основании, а цифрами Г, 2' и т.д. — атомы в остатке дезоксирибозы). Обращенные внутрь спирали азотистые основания нуклеотидов одной нити формируют водородные связи с азотистыми основаниями нуклеотидов второй нити, т.е. две нити ДНК удерживаются вместе многочисленными водородными связями, что делает такую структуру очень устойчивой. Каждая нить ДНК имеет 3'- и 5'-концы: у расположенных на этих концах нуклеотидов либо 3'-, либо 5'-группадезоксирибозы свободна и не участвует в формировании фосфодиэфирной связи. В двойной спирали ДНК две ее нити расположены антипараплельно, т.е. "навстречу" друг другу: на каждом конце двойной спирали находятся 3'-конец одной ее нити и 5'-конец другой.
|
| Рис.Х.24. Модель двухспиральной структуры молекулы ДНК по Уотсону и Крику |
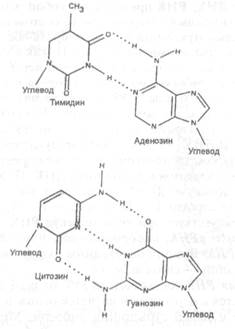
Уже давно было замечено, что количество входящих в состав молекулы ДНК пуриновых оснований (А + Г) равно количеству пиримидиновых оснований (Т + Ц). Это связано с тем, что в составе двойной спирали ДНК пурины образуют водородные связи только с пиримидинами, причем А образует связи (2 водородные связи) только с Т, а Г (3 водородные связи) — только с Ц. Длина структуры, образованной парами AT и ГЦ, примерно одинакова и составляет около 1,1 нм (рис.Х.26). Пара АГ была бы слишком велика, а пара ТЦ — слишком мала, чтобы точно соответствовать внутренним размерам двойной спирали ДНК. Таким образом, зная, какое азотистое основание находится в данном месте в одной нити ДНК, можно легко установить, какое азотистое основание будет находиться в этом месте во второй нити ДНК. Такое строгое соответствие нуклеотидов, расположенных в парных антипараллельных нитях молекулы ДНК, получило название комплементарности. Именно поэтому на каждой нити молекулы ДНК, как на матрице, можно синтезировать комплементарную ей вторую нить. Этот процесс позволяет живым организмам сохранять генетическую информацию и передавать ее без изменений в процессе деления дочерним клеткам, обеспечивая такое важное свойство живого, как наследственность.
|
| Рис.X.25. Фрагмент молекулы ДНК, в котором пуриновые и пиримидиновые основания, присоединенные к остаткам дезоксирибозы, удерживаются вместе ковалентными 3', 5'-фосфодиэфирными связями между этими остатками |
Итак, входящие в состав клеток молекулы ДНК представляют собой двухцепочечные нити, или двойную спираль. Только у некоторых ДНК-содержащих вирусов генетическая информация хранится в виде одноцепочечной ДНК.
В отличие от ДНК, РНК представляет собой, как правило, одноцепочечный линейный гетерополимер, состоящий из мононуклеотидов. Каждый нуклеотид в свою очередь состоит из одного из четырех азотистых оснований — А, Г и Ц (как в молекуле ДНК) и урацила (У, или U), который в РНК заменяет Т, остатка пятиуглеродного сахара рибозы и остатка фосфорной кислоты. Как и в молекуле ДНК, нуклеотиды в РНК ковалентно связаны друг с другом 3',5'-фосфодиэфирными мостиками. Поскольку РНК синтезируется, как на матрице, на одной из нитей определенного участка молекулы ДНК, то расположение нуклеотидов в ней, согласно принципу комплементарности, будет определяться последовательностью нуклеотидов в этой нити ДНК. При синтезе РНК напротив А (в молекуле ДНК) всегда будет располагаться У (в молекуле РНК), напротив Г — Ц, напротив Т — А, напротив Ц — Г. В клетках присутствует три типа молекул РНК: рибосомальная (рибосомная), или рРНК, информационная, или иРНК, и транспортная, или тРНК. Все они необходимы для реализации генетической информации — синтеза белка.
Рибосомальная РНК составляет до 85% от всей РНК в клетке. Она синтезируется в ядрышках и является основой для формирования большой и малой субъединиц рибосом. Молекулы рРНК состоят из нескольких тысяч нуклеотидов. Рибосомальная РНК, входящая в состав цитоплазматических рибосом эукариот, больше по размерам, чем рРНК рибосом прокариот, митохондрий и пластид.
| |
| Рис.Х.26. Образование водородных связей между комплементарными азотистыми основаниями по Уотсону и Крику |
Информационная РНК синтезируется в процессе транскрипции на определенном участке молекулы ДНК — гене, и содержит информацию о последовательности аминокислот в одном (у эукариот) или в нескольких (у прокариот) белках. Количество иРНК в клетке составляет около 5% от всей РНК и зависит от стадии клеточного цикла: при интенсивном синтезе белков количество иРНК повышается. Размеры иРНК определяются размерами кодируемых ими белков (или пептидов) и могут варьировать в широких пределах — от нескольких десятков до нескольких десятков тысяч нуклеотидов.
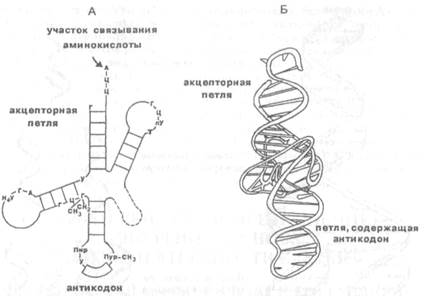
Транспортная РНК составляет около 10% от всей РНК клеток. Она невелика по размерам (75—90 нуклеотидов) и выполняет в клетке специфическую функцию: присоединяет определенную аминокислоту и доставляет ее к месту синтеза белка в рибосомы. Поэтому число разных тРНК должно соответствовать числу кодирующих аминокислоты триплетов (максимально 61). В молекуле тРНК определенные участки по принципу комплементарности образуют "шпильки", поэтому структура ее молекулы напоминает "клеверный лист" (рис.X.27). На одной из шпилек расположен триплет нуклеотидов — антикодон, комплементарный кодону в молекуле иРНК. На противоположном конце молекулы расположен акцепторный участок, к которому присоединяется аминокислота.
|
| Рис.Х.27. Структура молекулы тРНК (структура «клеверного листа») (А) и кон-формация, которую эта молекула принимает в растворе (Б) |
Итак, РНК в большинстве живых организмов присутствует в виде однонитевой молекулы, способной образовывать "шпильки". Только у некоторых РНК-содержащих вирусов обнаружена двухцепочечная РНК, структура которой близка к структуре ДНК. У этих организмов РНК, как двух-, так и одноцепочечная, выполняет функцию хранения генетической информации.
Самоудвоение ДНК. Сохранение и передача потомству генетической информации обеспечивается способностью ДНК к самоудвоению, или репликации (редупликации). По-видимому, на ранних этапах эволюции полинуклеотидные цепи были способны достраивать комплементарные цепи химическим (неферментативным) путем. В существующих в настоящее время живых организмах этот сложный и многостадийный процесс контролируется рядом ферментов и осуществляется на определенных стадиях клеточного цикла — перед началом митоза или мейоза.
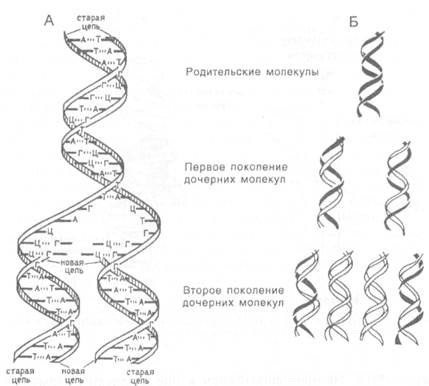
Сначала специальные ферменты "раскручивают" и "расплетают" двойную спираль ДНК, разрывая водородные связи между парами комплементарных азотистых оснований (рис.Х.28). Затем на образовавшихся одноцепочечных участках материнской молекулы ДНК, как на матрицах, с помощью фермента ДНК-полимеразы начинают собираться дочерние нити. Для их синтеза используются дезоксинуклеотиды — дАТФ, дГТФ, дЦТФ и дТТФ, которые выстраиваются в дочерней нити, образуя комплементарные пары с нуклеотидами материнской нити так, что напротив А всегда будет стоять Т, напротив Г— Ц и т.д.
|
| Рис.X.28. Схема репликации двухцепочечной молекулы ДНК. Каждая из двух цепей родительской молекулы ДНК используется в качестве матрицы для синтеза новых комплементарных нитей (А). Схема, иллюстрирующая полуконсервативный характер репликации ДНК. Родительские цепи ДНК (Б) |
На одной нити ДНК синтез дочерней молекулы идет непрерывно, а на второй — фрагментами в обратном направлении. Образующиеся фрагменты сшиваются вместе специальным ферментом — ДНК-лигазой. В конечном итоге образуются две новые двухцепочечные молекулы ДНК, точные копии друг друга и материнской молекулы, причем в каждой из них одна нить ДНК является материнской, а вторая — вновь синтезированной дочерней (см. рис.Х.28). Такой способ репликации называется полуконсервативным; он обеспечивает точное соответствие нуклеотидной последовательности дочерних молекул ДНК материнской ДНК.
Поскольку точная передача информации от материнской молекулы ДНК к дочерним жизненно важна для живых организмов, за процессом репликации строго "следят" специальные ферменты. Если в процессе синтеза происходят ошибки и в дочернюю цепь включаются "неправильные" (некомплементарные) нуклеотиды, эти ферменты вырезают их и достраивают в месте разрыва "правильный" (комплементарный) кусок, а затем сшивают цепь. Аналогичные ферменты постоянно "следят" за состоянием молекул ДНК и в неделящихся клетках. Если в одной из нитей ДНК под действием химических или физических факторов (мутагенных веществ, ионизирующего излучения, УФ-излучения) возникают какие-либо нарушения, ферменты "исправляют" их, восстанавливая исходную структуру ДНК. Такой процесс называется репарацией. Если же в молекуле ДНК (или в одной из ее нитей) ошибки все-таки появляются, их следствием будут мутации, которые могут привести к изменениям свойств и признаков организма и закрепиться (или, наоборот, элиминироваться) в процессе эволюции.
Дата добавления: 2015-06-12; просмотров: 1913;
