НЕОРГАНИЧЕСКИЕ ВЕЩЕСТВА
Содержание химических элементов в клетке. В клетках живых организмов встречается около 90 различных химических элементов, причем примерно 25 из них обнаружено практически во всех клетках, т.е. все они необходимы для их жизнедеятельности. По содержанию химических элементов клетки значительно отличаются от объектов неживой природы, что в первую очередь связано с присутствием в них больших количеств органических соединений — белков, жиров, углеводов и нуклеиновых кислот. Кроме того, некоторые химические элементы входят в состав биологически активных веществ и выполняют в клетках специфические функции. Например, соединения кремния и алюминия, широко распространенные в земной коре, практически не встречаются в живых организмах. Исключение составляют ткани хвощей, раковины диатомовых водорослей и радиолярий, в которых кремнезем выполняет структурную и защитную функции.
По содержанию в живых системах все химические элементы подразделяются на три большие группы: макроэлементы (не меньше 10-3 %), микроэлементы (от 10~-12 до 10 -3 %) и ультрамикроэлементы (не больше 10-12 %). На долю макроэлементов в сумме приходится около 99%, на долю микроэлементов — менее 1%, а ультрамикроэлементов — менее 0,01% массы клеток.
Обычно среди макроэлементоввыделяют две большие группы. В первую группу входят кислород (65—75%), углерод (15—18%), водород (8—10%) и азот (1,5—3%), в сумме составляющие около 98% от массы клеток. Эти четыре элемента входят в состав органических соединений; кроме того, из водорода и кислорода состоит вода, на долю которой приходится не менее 2/3 содержимого большинства клеток.
Вторую группу представляют фосфор (0,2 –1%), калий (0,15 – 0,4%), сера (0,15 – 0,2%), хлор (0,05 – 0,1%), кальций (0,04 – 2%), магний (0,02 – 0,03%), натрий (0,02 – 0,03%), железо (0,01 – 0,015%), в сумме составляющие около 1,9%. Эти элементы также важны для обеспечения жизнедеятельности организма. Так, кальциевые соли фосфорной кислоты составляют основу костного скелета позвоночных; фосфорная кислота входит в состав нуклеиновых кислот, нуклеотидов, фосфолипидов, а ее соли играют главную роль в поддержании рН цитоплазмы клеток и внеклеточных жидкостей (плазмы крови, тканевой жидкости, лимфы). Концентрация ионов калия и натрия в цитоплазме и внеклеточных жидкостях значительно различается: в клетке много калия и мало натрия, поскольку натрий с затратой энергии АТФ удаляется из цитоплазмы во внешнюю среду в обмен на калий. Благодаря этому на внешней мембране клеток создается электрический потенциал, необходимый для нормального функционирования возбудимых (нервная, мышечная, секреторные) и других тканей. Направленный внутрь клетки градиент концентрации ионов натрия используется также для транспорта в клетку сахаров, аминокислот и других соединений. Хлорид-ион компенсирует электрические токи через клеточные мембраны, возникающие при возбуждении клеток, а у высших позвоночных значительные количества хлора секретируются в составе соляной кислоты специальными клетками слизистой оболочки желудка. Сера — необходимый компонент белков (аминокислоты цистеин и метионин), коферментов (кофермент А, липоевая кислота) и простетических групп ряда ферментов. Кальций нужен не только для построения костей, но и для свертывания крови, обеспечения разных форм клеточной подвижности, секреции и регуляции многих клеточных функций. Магний входит в состав хлорофилла растений, нуклеиновые кислоты присутствуют в клетках, АТФ участвует во всех реакциях в виде магниевых солей. Многие ферменты нуждаются в магнии для проявления своей активности. Железо входит в состав гемоглобина и миоглобина, оно необходимо также для работы ферментов дыхательной цепи митохондрий (цитохромов) и ряда других белков. Таким образом, даже беглый обзор позволяет увидеть, что макроэлементы обеспечивают многие функции живых клеток.
К микроэлементамотносятся марганец, медь, цинк, кобальт, никель, йод, фтор. Фтор нужен для нормального развития эмализубов, йод — активный компонент гормонов щитовидной железы, а цинк — поджелудочной железы, кобальт входит в состав витамина В12 и т.д.
Из ультрамикроэлементов (серебро, золото, бром, бор, мышьяк, селен и др.) можно назвать, например, бор, соединения которого необходимы для нормального роста и развития растений, или селен, недостаток которого приводит к развитию раковых заболеваний. Следует, однако, помнить, что в больших количествах многие микроэлементы и ультрамикроэлементы токсичны для организмов.
Вода и ее роль в жизнедеятельности клетки. Особое место среди неорганических соединений живых клеток занимает вода. Ее содержание в клетках может колебаться от 10% (сухие семена растений) до 90—95% (эмбриональные клетки, нервная ткань, клетки многих водных организмов). В среднем на долю воды приходится не менее 2/3 от общей массы живых организмов. Как правило, содержание воды больше у молодых растущих организмов, а в процессе старения ее количество снижается. Поскольку жизнь возникла, как предполагается, в водах Мирового океана, столь высокое содержание воды в живых организмах вполне объяснимо. Кроме того, многие свойства воды успешно используются организмами в процессе жизнедеятельности.
По химическим и физическим свойствам вода представляет собой уникальное соединение. По сравнению с большинством других жидкостей она характеризуется необычайно высокими температурами плавления и кипения, удельной теплоемкостью и электропроводностью, теплотой плавления и испарения, большим поверхностным натяжением. Все эти свойства связаны с тем, что молекулы воды гораздо прочнее связаны друг с другом, чем молекулы других растворителей. Входящие в состав молекулы воды атом кислорода и два атома водорода связаны прочными ковалентными связями за счет общих пар электронов на внешних электронных орбиталях. Однако более электроотрицательный атом кислорода оттягивает на себя эти электронные пары, приобретая частичный отрицательный заряд, тогда как атомы водорода заряжаются частично положительно. Поэтому между атомом кислорода одной молекулы и атомом водорода другой (или других) молекулы воды возникает слабое электростатическое взаимодействие, приводящее к образованию водородной связи (рис.Х.11, А). Несмотря на то что водородные связи между молекулами очень слабые (для разрыва такой связи требуется примерно в 20 раз меньше энергии, чем для разрыва ковалентной связи), их огромное количество "структурирует" воду. Это приводит к резкому увеличению температуры плавления и кипения воды и увеличивает ее теплоемкость.
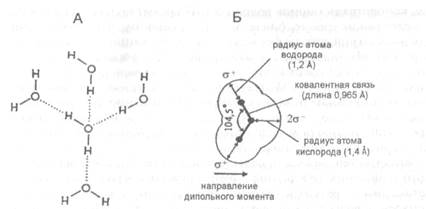
|
| Рис.Х.11. Схематическое изображение водородных связей (показаны точками) между молекулами воды (А). Схема, иллюстрирующая дипольные свойства молекулы (Б) |
Кроме того, поскольку атом кислорода в молекуле воды имеет частичный отрицательный заряд, атомы водорода — положительный, а угол связи Н-О-Н составляет 104,5°, молекула воды приобретает свойства диполя, когда одна ее часть заряжена отрицательно, а другая положительно (рис.Х.II, Б). В связи с этим молекулы воды могут приобретать определенную ориентацию в электрическом поле, а также взаимодействовать с ионами или заряженными группами различных соединений, образуя вокруг них гидратную оболочку. Этим объясняется способность воды хорошо растворять большое число неорганических и полярных органических соединений (различных солей, углеводов, аминокислот, нуклеотидов, многих белков и т.д.) Вещества, вступающие с молекулами воды в электростатические взаимодействия и, как следствие, хорошо в ней растворяющиеся, называют гидрофильными. С другой стороны, большое число органических соединений (в первую очередь липиды) практически нерастворимы в воде. Такие вещества называют гидрофобными. Именно гидрофобный слой биологических мембран выполняет функцию барьера, отделяющего содержимое клетки от внешней среды или содержимое клеточных органоидов от цитоплазмы. Способность воды проникать через такой барьер из раствора с низкой концентрацией солей или гидрофильных органических соединений в раствор с высокими концентрациями этих веществ лежит в основе осмоса, который обеспечивает поступление воды в клетки, поддержание тургора, движение воды и солей по проводящим пучкам растений и т.д.
Важным свойством воды является способность ее молекул диссоциировать на ионы водорода (протоны, Н+) и гидроксила (ОН-), которые участвуют во многих биохимических процессах, в первую очередь в окислительно-восстановительных реакциях. В клетках концентрация ионов водорода (рН среды) поддерживается на определенном уровне, близком к нейтральному, что необходимо для нормальной работы ферментов. В поддержании определенного значения рН важную роль играют соли фосфорной и угольной кислот, а также низкомолекулярные и высокомолекулярные органические соединения. Молекула воды также может участвовать во многих химических реакциях, например в реакциях гидролиза (разрыва ковалентной связи с присоединением к образовавшимся продуктам водорода и гидроксила) или гидрирования (присоединения молекулы воды по двойной связи).
Высокая теплоемкость воды (поглощение тепла без значительного изменения собственной температуры) предохраняет живые организмы от резких колебаний температуры, а высокая теплота испарения воды в процессах транспирации растений и потоотделения животных защищает их от перегрева при высоких температурах. Высокая теплопроводность воды обеспечивает быстрое выравнивание температуры в разных частях тела многоклеточных организмов, а ее несжимаемость придает клеткам и тканям упругость.
Дата добавления: 2015-06-12; просмотров: 1479;
