Сложные углеводородные смеси.
Если молекулярные реакции протекают независимо друг от друга, то цепные же реакции, протекающие в данной системе, всегда взаимосвязаны и, как правило, имеют общие стадии инициирования и обрыва цепей.
Соотношение скоростей разложения различных углеводородов в смеси равно соотношению констант скоростей реакции радикалов, ведущих цепь с данными углеводородами. Соотношение констант скоростей данного радикала с различными углеводородами определяется главным образом значениями энергии активации, так как значение предэкспоненциальных множителей близки.
Из углеводородов нефтяных фракций слабейшие связи, по-видимому, содержат ароматические углеводороды. Так, прочность связи типа: 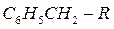 зависит от вида
зависит от вида 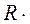 и энергия связи уменьшается при увеличении числа атомов углерода в
и энергия связи уменьшается при увеличении числа атомов углерода в 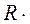 .
.
При наличии в углеводородной смеси метилзамещенных ароматических углеводородов наиболее вероятен обрыв цепей в результате образования бензилподобного радикала при реакциях, типа:
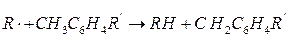
Экспериментально найдено, что термическое разложение углеводородных смесей проходит по реакции первого порядка.
Если исходная смесь углеводородов не содержит алкилароматических углеводородов, имеющих связи С-С, сопряженные с ароматическим кольцом, то инициирование цепей при образовании небольших количеств олефинов 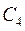 и выше происходит с такой же скоростью. Связано это с тем, что прочность связей С-С, сопряженных с π-связью, в олефинах такая же, как в алкилароматических углеводородах.
и выше происходит с такой же скоростью. Связано это с тем, что прочность связей С-С, сопряженных с π-связью, в олефинах такая же, как в алкилароматических углеводородах.
Углеводород, разлагающийся термически в чистом виде по нецепному механизму (это происходит вследствие того, что развивающие цепи радикала образуются с очень малой скоростью) в смеси с другими углеводородами может распадаться по цепному механизму, так как стадия инициирования протекает в этом случае со значительно большей скоростью. Таким образом, при термическом разложении смесей углеводородов радикально-цепные реакции играют основную роль.
Следовательно, термический распад углеводорода в смеси с другими углеводородами должен проходить во многих случаях с большей скоростью, чем в чистом виде.
Не менее важно, что крекинг ряда углеводородов в смеси должен сильно тормозиться относительно разложения углеводорода в чистом виде. Это явление характерно для тех случаев, когда радикал А•, образующийся при отрыве атома водорода от данного углеводорода А, стабилен относительно распада и с достаточно с большой скоростью вступает в реакцию замещения с другими углеводородами, имеющимися в смеси.
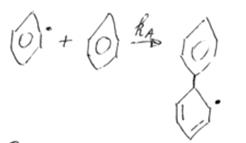 Например, при разложении бензола цепь развивается в результате присоединения фенильного радикала к молекуле бензола.
Например, при разложении бензола цепь развивается в результате присоединения фенильного радикала к молекуле бензола.
Если же бензол находится в смеси с другими углеводородами, то фенильный радикал может также вступить в реакцию:
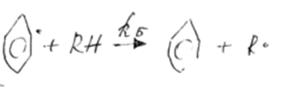
При константе скорости второй реакции во много раз большей, чем первой: 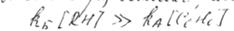 очевидно, что бензол не расходуется.
очевидно, что бензол не расходуется.
Действительно, при пиролизе смесей парафино-нафтеновых углеводородов с бензолом последний практически не разлагается при почти полном разложении парафинов и нафтенов.
При термическом разложении этилена при температурах, когда винильного радикала по реакции: 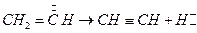 - несуществен, этилен расходуется в результате реакции:
- несуществен, этилен расходуется в результате реакции: 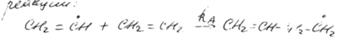 (
( 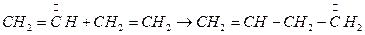 )
)
При крекинге этилена в смеси с другими углеводородами винильный радикал может стабилизироваться в этилен по реакции:
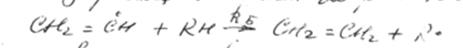
при 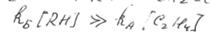 этилен не расходуется.
этилен не расходуется.
В сложных углеводородных смесях в некоторых случаях может существенно изменяться состав продуктов термического распада какого-либо индивидуального углеводорода.
Например, толуол в чистом виде дает при термическом распаде в основном продукты конденсации. А при термическом разложении в смеси с другими углеводородами бензильный радикал, при реакциях с олефинами легко превращается в толуол:
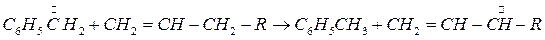
и конденсация подавляется.
Также может происходить деметилирование толуола по реакции: 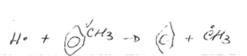
как в газе над давлением 10 МПа. Поэтому проведение крекинга в жидкой фазе с точки зрения соотношения скоростей моно- и бимолекулярных реакций равносильно проведению их в газовой фазе под высоким давлением. В результате при равных температурах жидкофазные термические реакции углеводородов и нефтепродуктов дают значительно больший выход продуктов конденсации и меньше продуктов распада. При распаде молекул углеводорода на радикалы в газовой фазе они немедленно разлетаются. В жидкой фазе радикалы окружены «клеткой» из соседних молекул. Для удаления радикала из этой «клетки» , при котором они становятся кинетически независимыми частицами, необходимо преодолеть дополнительный активационный барьер, равный энергии активации диффузии радикала из «клетки». Клеточный эффект может изменить энергию активации суммарной жидкофазной реакции по сравнению с газофазной.
Вторым фактором, вносящим различия между жидкофазным и газофазным крекингом, является сольватация молекул в жидкой фазе. В жидкой фазе осуществляется межмолекулярное взаимодействие между близрасположенными частицами, которые в общем случае называются сольватацией. Различают неспецифическую и специфическую сольватацию. Неспецифическая сольватация осуществляется под действием неспецифических и ненасыщаемых сил ВандерВаальса (ориент., индукц., дисперс.). специфическая сольватация связана со специфическими насыщаемыми силами, вызывающими образование водородных связей, π-комплексов и других донорно-акценторных комплексов. Неспецифическая сольватация осуществляется всегда независимо от полярности молекул веществ, находящихмя в жидкой фазе, но для неполярных веществ она очень слаба и существенно влиять на скорость реакции не может, особенно при высоких температурах. Для полярных и поляризуемых частиц межмолекулярное взаимодействие имеет электростатическую природу и значительно сильнее. Она оказывает существенное влияние на скорость взаимодействия полярных частиц. Но в условиях крекинга углеводородов, не имеющих значительную полярность, скорость термических реакций углеводородов под влиянием сольватации меняется не более, чем в 1.5-2 раза.
В современной нефтеперерабатывающей и нефтехимической промышленности имеют место как парофазное (пиролиз), так и жидкофазное (коксование) термическое превращение углеводородного сырья.
Суммарные реакции, протекающие при пиролизе и коксовании, можно разделить на три основные группы:
1. Первичные реакции распада и дегидрирования;
2. 2. Вторичные реакции превращения с участием олефинов;
3. 3. Реакции прямого молекулярного распада, вследствие которого образуется пироуглерод, водород и частично ацетилен.
В процессах пиролиза при высоких температурах молекулы имеют высокую энергонасыщенность и возрастает концентрация радикалов. Это приводит к уменьшению длины цепи и увеличению роли радикально-нецепного разложения, когда отдельные углеводороды разлагаются независимо друг от друга.
Повышение температуры в большей степени ускоряет реакции, имеющих более высокие энергии активации. При повышении температуры возрастает значение более энергоемких реакций распада радикалов, по сравнению с менее энергоемкими реакциями присоединения.
С повышением температуры изменяется также соотношения различных реакций превращения образующихся олефинов, то есть вторичных реакций. Распад олефинов, протекающий с высокими энергиями активации, сильно возрастает, по сравнению с реакциями конденсации олефинов.
Таким образом, скорость реакций первой и третьей групп возрастает быстрее, чем реакции второй группы, то есть реакций конденсации, присоединения.
Температурный режим пиролиза необходимо выбрать так, чтобы скорость первичных реакций была выше скорости вторичных реакций, но температура должна быть не настолько высокой, чтобы не преобладали реакции молекулярного распада.
В жидкофазных термических процессах возможно образование кокса – твердого вещества с высоким содержанием углерода, нерастворимого в бензоле. Кокс состоит из карбенов в-в, нерастворимых в бензоле и сероуглероде, и карбенов, нерастворимых во всех растворителях. Остальное соотношение С:Н в коксе составляет 2-4, а для образцов, полученных при низких температцрах, оно значительно ниже (1.1-1.25). плотность кокса обычно 1.4-1.5 г/см3. Содержание карбенов в коксе очень невелико – обычно не более 2% и тем ниже, чем выше температура образования кокса. Карбены являются высокомолекулярными веществами и представляют собой высокомолекулярные полимеры с м.м. 100-135 тыс.
Карбоиды являются сшитыми трехмерными полимерами, значительная часть атомов углерода которого занята в конденсированных ароматических структурах.
При термическом разложении в жидкой фазе парафиновых, олефиновых и циклопарафиновых углеводородов кокс образуется в результате вторичных реакций продуктов, их глубокого разложения. Непосредственно из этих углеводородов кокс не образуется. Образование кокса при термическом разложении ароматических углеводородов происходит, в зависимости от их строения, с различной скоростью.
Образование коса происходит в результате ряда последовательных реакций конденсации, дающих продукты с увеличивающимися молекулярной массой и ароматизированностью по схеме:
ароматич.углеводороды → асфальтены → кокс → графит
Термическое разложение асфальтенов, выделенных из нефти, протекает при атмосферном давлении в тоне инертного газа непосредственно с образованием кокса без промежуточных стадий:
асфальтены → кокс + легкие продукты.
В процессе коксования одним из целевых продуктов является нефтяной кокс. Он образуется из ароматических углеводородов по следующей схеме:
ароматич.углеводороды → смолы → асфальтены → кокс → графит.
Процесс коксообразования протекает по радикально-цепному механизму. Асфальтены, образовавшиеся при уплотнении углеводородов, втсупают в дальнейшие реакции поликонденсации.
Основные реакции термического превращения углеводородов:
1. Распад;
2. Дегидрирование;
3. Полимеризация;
4. Циклизация непредельных;
5. Деалкилирование;
6. Дециклизация;
7. Деструктивная конденсация олефинов;
8. Конденсация диолефинов с моноолефинами с образованием циклических структур;
9. Конденсация ароматических углеводородов;
10. Реакции глубокого уплотнения до кокса.
ЛЕКЦИЯ №9
Дата добавления: 2015-06-12; просмотров: 1594;
