Первичная структура
Первичная структура белка – линейная специфическая последовательность аминокислот, соединенных между собой пептидными связями. Пептиды и полипептиды состоят менее чем из 50 аминокислот, белки содержат более 50 аминокислот в пептидной цепи.
Пептидные связи образуются между a-аминогруппой одной аминокислоты и a-карбоксильной группой другой аминокислоты. При образовании пептидной связи выделяется молекула воды. Процесс образования пептидной связи является эндергоничным, т.е. требует затраты энергии.
Характеристика пептидной связей:
1) копланарность – все атомы, входящие в пептидную группу, находятся в одной плоскости (рис. 2.1);
2) атом водорода аминогруппы и атом кислорода карбонильной группы находятся в транс-положении;
3) связь между атомом углерода карбонильной группы и атомом азота имеет частично двойной характер из-за p,p-сопряжения (сопряжение свободной пары электронов атома азота с p-электронами двойной связи С=О), поэтому свободное вращение вокруг пептидной связи невозможно;
4) пептидная связь является ковалентной и стабильной связью.
Роль первичной структуры:
1. Последовательность аминокислот в первичной структуре белка определяет специфичность белка.
2. Первичная структура генетически детерминирована и воспроизводится в процессе транскрипции и трансляции.
3. Первичная структура белка является основойдля формирования последующих структур белка за счет взаимодействия радикалов аминокислотных остатков полипептидной цепи.
4. Замена аминокислоты L-ряда на аминокислоту D-ряда может привести к полному исчезновению биологической активности пептида.
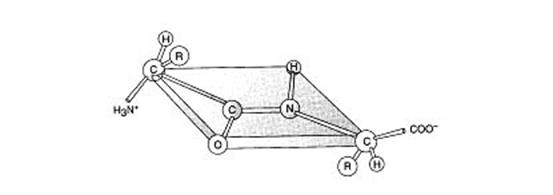
Рис. 2.1. Структура пептидной связи.
Пептид читается слева направо, начиная с аминокислоты, которая имеет свободную a-аминогруппу и заканчивается аминокислотным остатком, который имеет свободную a-карбоксильную группу. Для наименования пептида суффикс –ин (аланин), -ан (триптофан) и –ат (глутамат) заменяется на –ил, за исключением последней аминокислоты.
В живых организмах существуют пептиды, которые выполняют важные биологические функции. Биологически активные пептиды состоят из менее, чем 10 аминокислот.
1. Глутатион – трипептид, состоящий из g-глутаминовой кислоты, цистеина и глицина и присутствует в клетке в восстановленной и окисленной форме.
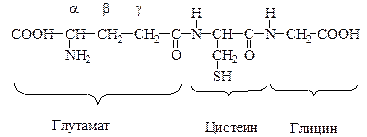
Функции:
- кофермент для некоторых ферментов;
- предотвращает окисление сульфгидрильных групп (-SH) белков до дисульфидных (-S-S), что необходимо для функционирования белков и ферментов;
- восстановленная форма глутатиона предотвращает повреждение эритроцитов и защищает гемоглобин от окисления H2O2;
- глутатион необходим для транспорта аминокислот через мембраны эпителия кишечника и почек (g-глутамильный цикл);
- глутатион является коферментом глутатионпероксидазы.
2. Тиролиберин–трипептид, секретируется гипоталамусом и стимулирует секрецию тиротропина в гипофизе.
3. Окситоцин. Синтезируется задней долей гипофиза и стимулирует сокращение матки. Состоит из 9 аминокислот.
4. Вазопрессин (антидиуретический гормон). Задерживает жидкость в организме и повышает артериальное давление. Состоит из 9 аминокислот, синтезируется задней долей гипофиза.
5. Ангиотензины. Ангиотензин I (декапептид) превращается в ангиотензин II (октапептид), вызывает сокращение сосудов.
6. Брадикинин и каллидин – нона- и декапептид, соответственно. Вызывают расслабление гладких мышц и являются продуктами протеолиза специфических α2-глобулинов плазмы. Поэтому эти пептиды содержат только протеиногенные аминокислоты. Могут образовываться в крови под действием яда змей.
7. Грамицидин S – антибиотик, синтезируемый B. brevis; является циклическим декапептидом, в составе которого, кроме протеиногенных аминокислот, имеется орнитин. Является ионофором, образуя в биологических мембранах каналы, образуют комплексы с ионами металлов.
8. Аманитины – токсичные октапептиды ядовитых грибов рода Amanita. Типичным представителем аманитинов является α-аманитин. Он блокирует синтез белка в клетках эукариот на стадии транскрипции. Замена в молекуле диоксиизолейцина на лейцин приводит к образованию нетоксичного соединения. В этих же грибах содержится ряд токсичных гептапептидов – фаллоидинов, имеющих сходное с аманитинами строение (бициклическое). Фаллоидины необратимо поражают печень млекопитающих. Роль противоядия фаллоидинам выполняет циклический декапептид – антаманид, содержащийся в тех же грибах, что и токсин.
В эволюционной биохимии особое внимание уделяется гомологичным (совпадающим) последовательностям аминокислот в анализируемых белках. Особая роль в структурном подобии белков принадлежит тождественным трипептидным группировкам, но в некоторых случаях находят совпадение в чередовании более обширных фрагментов. Так, Ю.Б.Филиппович (1999) сообщил, что в 52 рибосомных белках тождественные трипептидные блоки повторяются 657 раз, тетрапептидные – 86 раз и пентапептидные – 11 раз. В ряде случаев первичные структуры различных белков включают половину или более тождественных пептидных фрагментов. Особенно близки по строению белки с одинаковой функцией. Например, у цитохромов, выделенных из сине-зеленых, красных и бурых водорослей, первичные структуры совпадают на 48-67%.
Полиморфизм белков - существование одного и того же белка в нескольких молекулярных формах, отличающихся по первичной структуре, физико-химическим свойствам и проявлениям биологической активности. Причинами полиморфизма белков являются рекомбинации и мутации генов. Изобелки - это множественные молекулярные формы белка, обнаруживаемые в пределах организмов одного биологического вида, как результат наличия более чем одного структурного гена в генофонде вида. Множественные гены могут быть представлены как множественные аллели или как множественные генные локусы.
Полиморфизма белков имеет следующее биологическое значение:
1) Полиморфизм белков в филогенезе - существование гомологичных белков у разных видов. У этих белков консервативными (неизменяемыми) остаются участки первичной структуры, отвечающие за функцию белка. Для замещения утраченных белков в организме человека используют такие гомологичные белки животных, в первичной структуре которых имеются минимальные различия (инсулин быка, свиньи, кашалота).
2) Полиморфизм белков в онтогенезе - существование гомологичных белков в разные отрезки жизненного цикла организма. У плода имеется гемоглобин F (фетальный гемоглобин, a2g2,, имеет большое сродство к кислороду). После рождения он заменяется на гемоглобин А1 (a2b2).
3) Тканевой полиморфизм белков. Один и тот же фермент в разных клетках катализирует одну и ту же реакцию, но имеет отличия в первичной структуре - изоферменты. Изоферменты – это эволюционно закрепленные формы одного и того же фермента, приспособленные к функционированию в органах с отличающимися условиями протекания катализируемой химической реакции. Определение изоферментов в крови помогает диагностировать поражение определенной ткани.
4) Полиморфизм белков при патологии. Рассмотрим на примере множественных форм гемоглобинов. Они возникают в результате точечных мутаций, передаваемых по наследству. При этом чаще всего происходит замена кислой аминокислоты на основную или нейтральную:
в Нв С замена 6 глу в b-цепи на лиз;
в Нв Е замена 26 глу в b-цепи на лиз;
в Нв J замена 16 лиз в b-цепи на асп;
в Нв S замена 6 глу в b-цепи на вал;
В последнем случае возникает заболевание серповидно-клеточная анемия. Аномальные гемоглобины отличаются от нормального величиной заряда и электрофоретической подвижностью. Физико-химические изменения гемоглобинов сопровождаются нарушением транспорта кислорода.
Дата добавления: 2015-06-12; просмотров: 1755;
