Характеристика и классификации аминокислот
Аминокислоты являются структурной единицей белков. Аминокислоты содержат аминогруппу (-NH2), карбоксильную группу (-СООН), атом водорода и боковую цепь, связанную с α-углеродным атомом. Одна из 20 аминокислот, пролин, является, иминокислотой (-NH-), остальные 19 являются α-аминокислотами.
В природе выявлено около 300 аминокислот. Из них 20 являются стандартными (протеиногенными) аминокислотами, которые обнаружены в структуре белков, полученных из различных организмов – животных, растений и микроорганизмов.
Существует несколько классификаций аминокислот, основанные на структуре и химической природе, заменимости, путях метаболизма и т.д.
Классификация аминокислот по полярности радикалов:
1. Неполярные аминокислоты (аланин, валин, лейцин, изолейцин, метионин, фенилаланин, триптофан, пролин). Эти аминокислоты гидрофобны. Имеют незаряженный радикал.
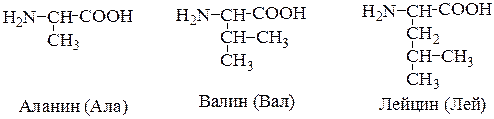

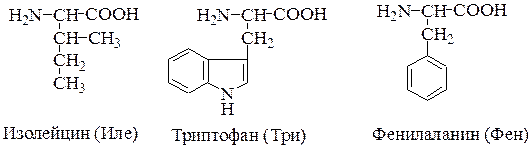
2. Полярные, гидрофильные, незаряженные аминокислоты (глицин, треонин, цистеин, тирозин, серин, аспарагин, глутамин). Содержат такие полярные функциональные группы как гидроксильная, сульфгидрильная и амидогруппа.
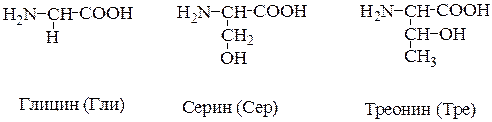
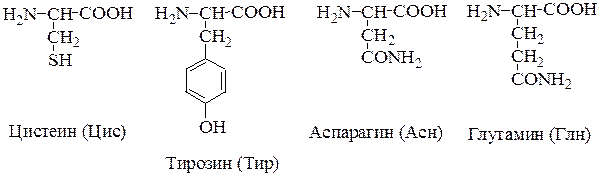
3. Кислые аминокислоты (отрицательно заряженные аминокислоты) имеют отрицательный заряд (аспартат, глутамат) при рН 7,0

4. Основные аминокислоты (положительно заряженные аминокислоты) имеют положительный заряд при рН 7,0.

Аминокислоты классифицируются на заменимые и незаменимые (эссенциальные).
1. Незаменимые (эссенциальные) аминокислоты не могут синтезироваться в организме и должны поступать с пищей. Они необходимы для обеспечения и поддержания роста: аргинин, гистидин, изолейцин, лейцин, лизин, метионин, фенилаланин, треонин, триптофан, валин.
2. Заменимые аминокислоты. Организм может синтезировать около 10 аминокислот для обеспечения биологических потребностей, поэтому поступление их с пищей не обязательно (аланин, аспарагин, аспартат, цистеин, глутамат, глутамин, глицин, пролин, серин, тирозин).
Углеродный скелет аминокислот является предшественником для синтеза глюкозы или гликогена (гликогенные аминокислоты: аланин, аргинин, аспаргиновая кислота, глутаминовая кислота, глицин, гистидин, метионин, пролин, серин, треонин, валин, цистеин), липидов (кетогенные аминокислоты: лейцин) или глюкозы и липидов (гликогенные и кетогенные аминокислоты – изолейцин, лизин, фенилаланин, триптофан, тирозин)
Кроме 20 стандартных аминокислот, присутствующих в составе белков, существуют аминокислоты, имеющие важное биологическое значение.
1. Производные аминокислот. 20 стандартных аминокислот могут включаться в белки из-за универсальности генетического кода. Некоторые из них подвергаются специфической модификации после биосинтеза белка. Эти производные аминокислот являются важными для структуры и функции белка. Например, коллаген содержит гидроксипролин и гидроксилизин; гистоны – метилированные, фосфорилированные и ацетилированные аминокислоты.
2. Непротеиногенные аминокислоты не обнаруживаются в составе белков, но выполняют важные функции в организме. Например, орнитин, цитруллин являются промежуточными метаболитами в биосинтезе мочевины.
3. D-аминокислоты. Аминокислоты животных и растений являются L-аминокислотами. D-аминокислоты обнаружены в антибиотиках или в бактериальных стенках.
Дата добавления: 2015-06-12; просмотров: 3463;
