Взаимосвязь структуры и функции
Рассмотрим на примере 2-х белков: миоглобина, который имеет третичную структуру и способен запасать кислород и гемоглобина, который имеет четвертичную структуру (4 субъединицы, каждая из которых напоминает глобулу миоглобина) и способен как связывать, так и транспортировать кислород.
1. Миоглобин является белком мышечной ткани, который депонирует кислород и транспортирует его к митохондриям. Для выполнения этой функции миоглобин должен обладать способностью связывать кислород при низком парциальном давлении кислорода, когда гемоглобин его отдает. Кривая насыщения миоглобина кислородом имеет вид гиперболы (рис. 2.4). Парциальное давление кислорода рО2 в ткани, окружающей легочные капилляры составляет 100 мм рт. ст. Поэтому миоглобин в легких мог бы весьма эффективно насыщаться кислородом. В венозной крови рО2 равно 40 мм.рт.ст., а в активно работающей мышце – около 20 мм.рт.ст. Но даже при таком рО2 степень насыщения миоглобина кислородом будет весьма высокой (около 80%) и поэтому миоглобин не может отдавать кислород тканям. Однако при кислородном голодании (тяжелая физическая нагрузка) рО2 уменьшается до 5 мм т.ст. и миоглобин может отдавать связанный кислород.
2. Структура миоглобина.Миоглобин является глобулярным белком (м.м. 17 000 Да), который состоит из 153 аминокислотных остатка. Около 75% полипептидной цепи спирализовано и образует 8 правых α-спиралей (обозначается буквами от А до Н). Полярные гидрофильные фрагменты расположены снаружи спирали, а неполярные гидрофобные – внутри молекулы (рис. 2.5).
Гем является простетической группой миоглобина и гемоглобина. Без гема миоглобин кислород не связывает. Гем состоит из железа (Fe2+) и пропопорфиринового кольца – протопорфирин IX. (Fe2+) связано 4 координационными связями с пиррольными кольцами протопорфирина IX. Гем находится в гидрофобном кармане молекулы миоглобина. Пятая координационная связь образуется между атомом железа и остатком гистидина F8 (проксимальный гистидин). Шестая координационная связь образуется с молекулой кислорода, который встраивается между атомом железа и дистальным гистидином Е7. В неоксигенированном миоглобине атом железа на 0,03 нм выступает из плоскости кольца в направлении Гис F8. При связывании молекулы О2 с шестой координационной связью железа (оксигенированный миоглобин) атом железа втягивается в плоскость гема и выступает из нее только на 0,01 нм.
Таким образом, связывание О2 с молекулой миоглобина приводит: 1) к перемещению атома железа и 2) перемещающийся атом железа будет изменять положение проксимального Гис F8, а, следовательно, и конформацию α-спирали F и всей глобулы миоглобина.
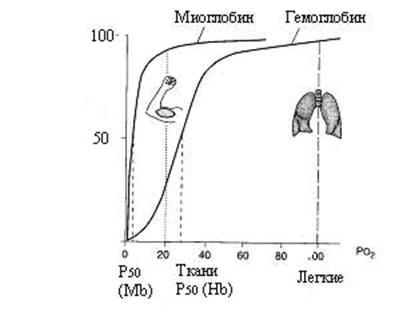
Рис. 2.4. Кривая насыщения миоглобина и гемоглобина кислородом.
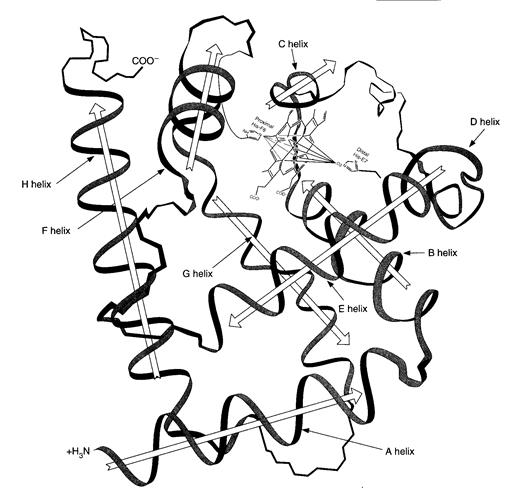
Рис. 2.5. Структура миоглобина.
1. Гемоглобин находится в эритроцитах и участвует в транспорте кислорода от легких к тканям и углекислого газа от периферических тканей к легким. Гемоглобин обладает способностью связывать кислород при высоком парциальном давлении кислорода (в легких) и высвобождать его в периферических тканях.
2.Гемоглобин – тетрамер, состоящий из четырех нековалентно связанных субъединиц, которые по структуре напоминают миоглобин (гемоглобин А1 состоит из α2β2). Подобно миоглобину, каждая субъединица имеет гидрофобный карман, в котором находится гем. Кривая насыщения гемоглобина кислородом имеет S-образный (сигмоидный) характер. В сравнении с миоглобином, гемоглобин связывает кислород при высоком парциальном давлении кислорода в легких и отдает его в мышцах, где миоглобин связывает кислород.
3. Кооперативный эффект. При связывании кислорода с шестой координационной связью железа атом железа втягивается в плоскость кольца. Это приводит к изменению положения проксимального гис F8 и конформации всей полипептидной цепи: поворот пары α/β на 15°. Такие изменения конформации облегчает связывание второй молекулы О2. В итоге кривая связывания кислорода гемоглобином имеет S-образный вид. Такой тип зависимости определяется кооперативным (совместным) действием всех субъединиц в интересах всей молекулы гемоглобина. Наличие кооперативного эффекта дает гемоглобину новое свойство транспорта газов: при 100 мм.рт.ст. (в легких) молекула гемоглобина полностью оксигенируется (получает 4 молекулы О2). Ниже 80 мм рт.ст. молекула гемоглобина отдает О2. Например, при рО2 = 20 мм рт.ст. гемоглобин насыщен примерно на 20% кислородом, а миоглобин на 82%. Т.е. очевидно, что оксигемоглобин будет отдавать О2, а миоглобин его связывать.
Дата добавления: 2015-06-12; просмотров: 2800;
