Типы электронных переходов.
Классификация электронных переходов производится по типам одноэлектронных молекулярных орбиталей, участвующих в переходе (например, по орбиталей 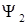 и
и 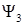 в формуле(1.6)). Переходы могут быть следующих типов:
в формуле(1.6)). Переходы могут быть следующих типов:
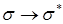 (вакуумный УФ)
(вакуумный УФ)
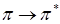 (УФ, видимая область)
(УФ, видимая область)
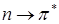 (УФ, видимая область)
(УФ, видимая область)
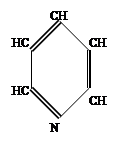 |
Поясним последний тип перехода на примере молекулы пиридина.
Рассмотрим электронное строение атома азота, входящего в кольцо. Он будет иметь гибридизацию SP2 и 1p электрон с волновой функцией, перпендикулярной плоскости кольца. Схема электронной конфигурации имеет вид:
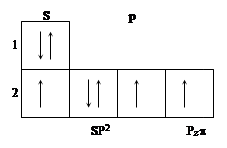 |
Пространственное расположение полярных диаграмм волновых функций можно представить следующим образом:
 |
Пунктиром показана не поделенная пара (n) электронов, имеющих гибридизацию sp2, не участвующая в образовании валентных связей. Одноэлектронные молекулярные орбитали молекулы пиридина имеют следующий вид:
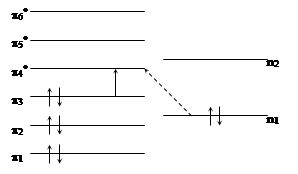 |
Незаполненные орбитали отмечены знаком «*». На схеме один из
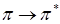 переходов отмечен сплошной стрелкой, а
переходов отмечен сплошной стрелкой, а 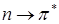 - пунктирной. Одноэлектронные молекулярные орбитали, участвующие в
- пунктирной. Одноэлектронные молекулярные орбитали, участвующие в 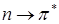 переходе, ортогональны между собой и поэтому эти переходы, как правило, имеют меньшую интенсивность, чем
переходе, ортогональны между собой и поэтому эти переходы, как правило, имеют меньшую интенсивность, чем 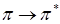 переходы. С помощью теории групп можно строго показать, что для
переходы. С помощью теории групп можно строго показать, что для 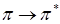 переходов дипольный момент перехода лежит в плоскости кольца, а в случае
переходов дипольный момент перехода лежит в плоскости кольца, а в случае 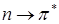 переходов момент перехода перпендикулярен плоскости кольца, а в случае переходов момент переходов перпендикулярен плоскости кольца.
переходов момент перехода перпендикулярен плоскости кольца, а в случае переходов момент переходов перпендикулярен плоскости кольца.
Дата добавления: 2015-06-10; просмотров: 2206;
