Положение спектра поглощения. Расчеты электронных уровней сложных молекул: одно- и много конфигурационное приближение.
Энергию электронного перехода можно рассчитать методами квантовой химии. Применим для этой цели уравнение Хартри-Фока. Они имеют вид:
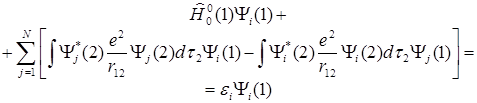 (1.3)
(1.3)
Здесь - одноэлектронный гамильтониан остова, - одноэлектронная спин-орбитальная функция, Yi - одноэлектронная энергия i-ой спин-орбитали.
Рассмотрим определение полной волновой функции молекулы в основном и возбужденных состояниях и соответствующих энергий, на примере системы с четырьмя электронами, в приближении замороженных орбиталей. Схема заполнения для основного состояния имеет вид:

Волновая функция основного состояния может быть записана следующим образом:
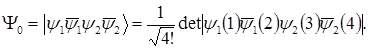 (1.4)
(1.4)
Энергия основного состояния равна:
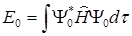 (1.5)
(1.5)
Здесь 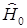 - гамильтониан системы, а
- гамильтониан системы, а 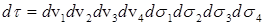 (интегрирование по координатам и суммирование по спинам всех электронов). Тогда
(интегрирование по координатам и суммирование по спинам всех электронов). Тогда
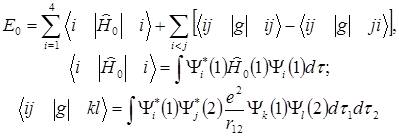
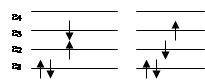 |
Возбужденные синглетные состояния описываются разностью двух детерминантов. Так, синглетное возбужденное состояние, возникающее при переходе электрона с обитали Y1 на орбиталь Y2 можно изобразить следующими схемами:
Волновая функция этого состояния может быть представлена в виде:
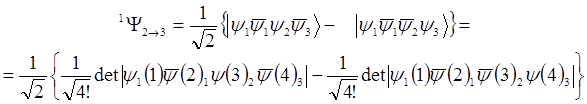 (1.6)
(1.6)
Энергия этого состояния может быть определена так:
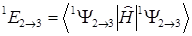 (1.7)
(1.7)
Эта величина вычисляется с помощью правила вычисления матричных элементов от детерминантных функций. Величины e1 и e2 входят в уравнение Хартри-Фока и представляют собой орбитальные, одноэлектронные энергии.
Соответствующее триплетное состояние описывается тремя функциями, имеющими разные значения проекций спина (Sz=1,0,-1):
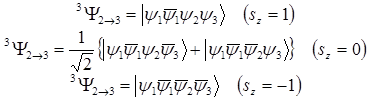 (1.8)
(1.8)
Энергия возбужденного триплетного состояния дается выражением:
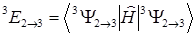 (1.9)
(1.9)
В матричном элементе может стоять любая функция (1.8). Используя выражения (1.5) и (1.8), можно получить выражение для энергий переходов через орбитальные энергии, кулоновские и обменные интегралы.
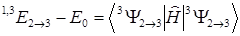 (1.9)
(1.9)
Формула (1.10) получена в так называемом одно-конфигурационном приближении. Знак «+» соответствует синглету, а знак «-« триплету. Поскольку K23 > 0, синглетный уровень лежит выше триплетного на величину 2K23.
Более низкие энергии возбужденных состояний получаются в так называемом много конфигурационном приближении, когда волновая функция возбужденного состояния ищется в виде линейной комбинации функций вида (1.6). Обычно берут для линейной комбинации функции, отвечающие самым нижним возбужденным состояниям. Для примера рассмотрим волновую функцию, составленную из двух волновых функций:
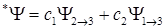
Функция Y1®3 определяется аналогично функции (1.6). Коэффициенты C1 и C2 линейной комбинации (1.10) определяются из однородной системы уравнений:
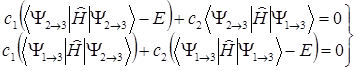 (1.11)
(1.11)
Энергии возбужденных состояний можно найти из уравнения:
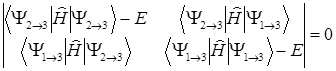
или
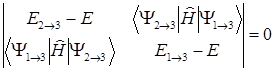 (1.12)
(1.12)
 |
При таком конфигурационном взаимодействии происходит расщепление первоначальных уровней, так что их центр тяжести остается на месте. Это можно показать на такой схеме:
(1.13)
Расщепление уровней наблюдается, если b¹0 , поэтому смешивающиеся волновые функции должны иметь одну и ту же симметрию.
Дата добавления: 2015-06-10; просмотров: 1040;
