РУ ТӘСІЛДЕРІ. Фазалар ережесі. Сұйық және қатты күйде шексіз еритін жүйелердің фазалық диаграммалары.
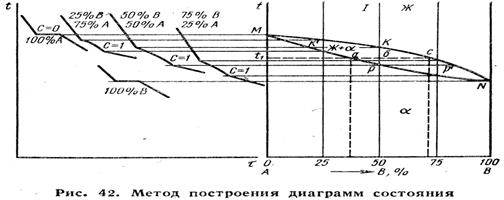
Диаграммалық күй температура мен концентрация функциясындағы берілген жүйе қорытпаларының фазалық күйінің графиктік бейнесі түрінде болады (42-сурет).
Концентрация өсіндегі сол жақтағы ең шеткі нүктеге А компоненттің проценттік үлесі осы осьтың бойымен солдан оңға қарай салынады. Оң жақтағы ең шеткі нүктеге екінші компоненттің (В) 100 проценттік үлесі сәйкес.
Таза элементтер арасындағы немесе негізгі солардан тұратын қатты ерітінділер арасындағы концентрациялар интервалында қорытпалар түзелетін аралық фазалардың болуы, диаграмманың осындай фазамен және кез келген бір-біріне тәуелсіз элемент арасындағы бөлігін қарастыруға мүмкідік береді.
Күй диаграммаларын, әдетте эксперимент түрінде құрастырады. Алайда, қазіргі кезде оларды термодинамикалық потенциалдары бойынша есептеудің (электронды есептеуіш машиналарды пайдалана отырып) теориялық тәсілдері жасалуда.
А және В компонеттерінен түзілген қорытпалардың күй диаграммаларын эксперимент жолымен құрастыру үшін, А және В компоненттерінің әр түрлі мөлшері бар қорытпалар сериясын дайындау қажет. Әрбір мұндай қорытпа үшін эксперимент арқылы салкындату қисығы құрастырылады, әрі сол бойынша кризистік нүктелерді, яғни фазалық түрлену температуралары анықталады.Зерттеліп отырған қорытпалардың алынған кризистік нүктелерінің мәндерін, осы қорытпалардың химиялық құрамына сәйкес келетін вертикаль сызықтардың бойына салады. Содан кейін белгілі бір фазалық түрленуге сәйкес келетін кризистік нүктелерді өзара қосып, күй диаграммасы сызықтарын алуға болады. МКN сызығы (42-сурет)-барлық жоғарғы нүктелердің геометриялық орны;ол қорытпалардың кристалдануының бастапқы температурасын анықтайды. Оны ликвидус (ликва – латынша «сұйық» деген сөз) сызығы деп атайды. МРN сызығы – барлық төменгі кризистік нүктелердің геометриялық орны; ол қорытпалардың кристалдануының аяқталу температурасын анықтайды. Оны солидус (солид – қатты) сызығы деп атайды. Бұл сызықтар күй диаграммасын белгілі бір фазалық құрамның аймақтарына бөледі.
Экспериментті түрде құрылған салқындату қисығы мен күйлер диаграммасын фазалар ережесі бойынша тексереді.
Фазалар ережесі берілген қысымдағы кристалдану процесінің температуралық шарттарын белгілейді, сондай-ақ компонентте не белгілі бір құрамдағы қорытпада (егер олар берілген температурада не қысымда тепе-теңдік күйде болса) қанша фаза болатынын анықтайды.
Қорытпаның тепе-теңдік фазалық күйі, фазалық құрамы, температурасы және қысымы арқылы анықталады. Қорытпаның фазалық құрамын түрлентпей – ақ, өзгертуге болатын факторлар санын еркіндік дәрежесі деп атайды.
Еркіндік дәрежесі (с) берілген температура мен қосымша тұрған қорытпадағы компоненттер саны (к) мен фазалар саны (ф) арқылы анықталады: с =к + 2 – ф .
Әдетте күй диаграммаларын тұрақты (атмосфералық) қысым үшін құрады. Бұл жағдай формулада мынадай түрде болады.
с =к + 1 – ф .
Таза компоненттер үшін еркіндік дәрежесінің мәні 0 немесе 1 болуы мүмкін. Фазалық құрам, бірінші жағдайда тек тұрақты температурада, ал екінші жағдайда температурада өзгергенде ғана өзгермейді. Мысалы, кристалдану процесінде таза элементтің екі фазасы (сұйық және қатты) бір мезгілде болады. Фазалар ережесі бойынша еркіндік дәрежесінің саны анықталды: с =к + 2 – ф =1 + 1 – 2=0. Бұның өзі – таза элементтің екі фазасы болған кезде кристалдану процесі изотермиялық жағдайда өтеді. (42-суретті қара) деген сөз. Бір фазаның жойылуы (толық қатайғанда не балқығанда) еркіндік дәрежесінің санын өзгертеді: с =1 + 1 – 1 =1, яғни салқындату қисығының учаскесіндегі кристалдану температурасынан жоғары не төмен температурада түрлену болмайды.
Екі компоненттен тұратын қос қорытпалардың еркіндік дәрежесінің мәні 0; 1 және 2 болуы да мүмкін.
Мұндай қоспаның (42-суретті қара) кристалдану процесіндегі еркіндік дәрежесі с = к +1- ф = 2 + 1 – 2 = 1 болады. Бұл – температура мен фазалар концентрациясы арасында функционалдық байланыс барлығын дәлелдейді. Қорытпаның кристалдану процесі, кристалдану жылуы бөлініп шығуына қарамастан, баяу болса да төмен температурада жүре береді. Кристалдану кезінде әрбір температураға белгілі бір концентрация және фазалар саны сәйкес келеді (концентрация ережесі және кесінділер ережесі).
Кейбір қос қорытпалардың (эвтектикалық, перитектикалық және т.б.) кристалдану кезінде фазалар саны үшке тең болуы мүмкін. Мұндай жағдайда с = 2 +1- 3 = 0, яғни процесс изотермиялық кейде әрі барлық үш фазаның тұрақты концентрациясында өтеді.
Концентрация ережесіБерілген температурада кристалдану кезіндегі қорытпа фазасының концентрациясын анықтайды. Берілген t1 температурадағы сұйық фаза концентрациясы(42-суретті қара) осы температурадағы ликвидус сызығында жатқан нүкте, яғни Жс нүктесі арқылы анықталады. Осы температурадағы қатты фаза концентрациясы солидус сызығында жатқан нүкте, яғни αа арқылы анықталады.
Сонымен, 1-қорытпаның кристалдану процесінде В компонентінің сұйық және қатты фазалары бір қалыпты болып таралмайды В компоненті А компонентіне қарағанда оңай балқитын компонент бола отырып, ол сұйық фазада көп мөлшерде сақталады да, жаңадан түзілетін α қатты кристалының құрамына аз мөлшерде енеді. Қиын балқитын А компоненті α кристалында үлкен мөлшерде жинақталады. Сұйық және қатты фазалардағы компоненттердің бір қалыпты таралмайтындығын таралу коэффициенті арқылы анықтайды: К= Жс/ αа. Бұл құбылыс аса таза жартылай өткізгіштерді алудың кристаллофизикалық әдісінің негізіне жатады (XXVI тарау).
Осы айтқандардан, бөлініп шығатын кристалдардың химиялық құрамы, температураның төмендеуіне сәйкес, солидус сызығының бойымен к1 нүктесінен дейін өзгереді деген қорытынды жасауға болады. Бұл кезде сұйық фазаның құрамы ликвидус сызығының бойымен к нүктесінен р1 нүктесіне дейін өзгереді, яғни сұйық оңай балқитын В компонентімен байытылады.
Дегенмен диффузия процесі салдарынан, өте баяу (тепе-тең)суыту кезінде (ал барлық диаграммалар осы жағдай үшін құрылады) қатты кристалдардың химиялық құрамы теңгеріледі және ол кристалдану процесінің соңында қорытпаның химиялық құрамына сәйкес келетін р нүктесі арқылы анықталады.
Нақты жағдайдағы суыту кезінде мұндай теңгерілу болмауы да мүмкін. Осы жағдайда бір кристалдың химиялық құрамы оның әр түрлі болады. Мұндай химиялық бір тексіздік микроликвация деп аталады.
Кесінді ережесі кристалдану кезіндегі фазалардың сандық ара қатынасын анықтайды. Мысалы, t1 температурада (42-суретті қара) қорытпадағы сұйық пен қатты фазалардың саны төмендегі ара қатынаспен анықталады:
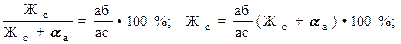
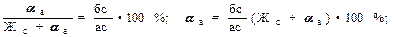
Мұндағы Жс + αа – қорытпаның жалпы саны.
Сонымен Жс сұйық фаза саны солидус сызығына жақын жатқан аб кесіндісіне пропорционал, ал αа қатты фаза саны ликвидус сызығына жатқан бс кесіндісіне пропорционал болады. Кристалдану процесі дамыған сайын сұйық фаза санын анықтайтын аб кесіндісі қысқарады, ал бс кесіндісі, керісінше ұзарады.
Дата добавления: 2015-06-10; просмотров: 3286;
