Фазовые состояния
Изучение соотношений различных фаз углеводородов имеет огромное значение для правильного понимания разного рода равновесий, существующих между флюидами в пределах нефтегазоносного пласта в обстановке меняющихся температур и давлений [2]. Температура и давление в залежи в процессе ее разработки изменяются, причем иногда очень резко. Большая часть современных методов добычи нефти и газа основана на знании поведения этих флюидов ‑ их фазовых состояний ‑ в пласте в процессе извле чения их из залежи. Эти знания получены в лабораториях ‑ химиками, физиками, переработчиками ‑ и путем изучения современных пластовых условий. Очень многие из изучаемых таким образом процессов и явлений представляют большой интерес для геолога-нефтяника, поскольку они могли происходить в пластовых условиях в.течение длительного геологического времени.
Порода-коллектор, вода, газ и нефть ‑ вот те различные материалы, которые к моменту открытия залежи находятся в нефтегазоносном пласте в состоянии равновесия и с которыми мы имеем дело в течение всего последующего периода ее разработки. В пласте-коллекторе существует множество систем¹, подлежащих изучению, ‑ это порода ‑ вода, порода ‑ газ, порода ‑ нефть, вода ‑ нефть, газ ‑ нефть, порода ‑ вода ‑ нефть, водные, нефтяные и газовые системы. Фаза включает все составляющие системы, обладающие одинаковыми свойствами и составом. Иными словами, фаза ‑ это гомогенная, отличающаяся физически и обособленная механически часть системы².
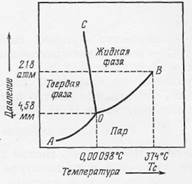
Фиг. 10-1. Схематическая диаграмма фазовых состояний воды.
Тройная точка О соответствует давлению 4,58 мм ртутного столба и температуре 0,0098°С. АО ‑ кривая сублимации льда и пара; ОС ‑ кривая равновесия льда и жидкости; ОВ ‑ кривая давления пара, т.е. кривая равновесия жидкости и пара. Эта диаграмма справедлива только для низких давлений.
Фазы отделены друг от друга отчетливыми физическими границами, называемыми поверхностями раздела или граничными поверхностями. Число компонентов системы является наименьшим числом независимых переменных составляющих, которые отражают строение и состав каждой из возможных присутствующих фаз. Например, такая система, как вода, может встречаться в виде трех фаз - парообразной, жидкой и твердой в зависимости от температуры и давления. Эта система представлена одной составляющей ‑ Н2О ‑ во всех фазах, иными словами, это однокомпонентная система. Система нефть - вода может рассматриваться в качестве двухкомпонентной; в пластовых и поверхностных условиях она часто встречается в трех фазах - природного газа, нефти и воды.
Типичной однокомпонентной системой является вода. На фиг. 10-1 приведена диаграмма этой системы в зависимости от двух переменных - температуры и низкого давления. На диаграмме показаны три самостоятельные фазы (лед, жидкость, пар) и три состояния равновесия двух фаз (лед ‑ пар по линии АО, лед - жидкость по линии ОС и пар - жидкость по линии ОВ; точка В соответствует критической температуре Тс). В точке О все три фазы находятся в равновесии. Это так называемая «тройная точка».
 Фазовое состояние вещества (или смеси веществ, например нефти) в любой данный отрезок времени определяется рядом независимых переменных, главным образом давлением и температурой, а также концентрацией, плотностью и объемом этих веществ.
Фазовое состояние вещества (или смеси веществ, например нефти) в любой данный отрезок времени определяется рядом независимых переменных, главным образом давлением и температурой, а также концентрацией, плотностью и объемом этих веществ.
¹Система представляет собой вещество или смесь веществ, изолированных друг от друга.
²Строго говоря, мы должны рассматривать систему метан - этан и фазы, газообразную и жидкую, в виде которых она встречается. С практической точки зрения целесообразнее рассматривать нефть как систему, состоящую из двух фаз - собственно нефти и растворенного в ней природного газа. Аналогично понимается в качестве двухкомпонентной наиболее обычная для продуктивного пласта система нефть ‑ вода.
Минимальное количество переменных, необходимое для определения остальных переменных данной системы и, следовательно, для установления фазового состояния этой системы называется степенью свободы. Например, если температура, давление, концентрация и объем достигли таких величин, что из жидкой фазы (нефти) начали образовываться мельчайшие пузырьки газовой фазы, значит, газ и нефть находятся в равновесии и будут находиться в этом состоянии до тех пор, пока останутся постоянными все эти параметры. Стоит измениться одному параметру, как тотчас изменятся и все остальные, и равновесие между нефтью и газом сохранится. Следовательно, такая система, как нефть, обладает лишь одной степенью свободы.
Общая связь между количеством степеней свободы, количеством компонентов и количеством фаз в системе выражается правилом фаз, выведенным впервые в 1876 г. Гиббсом:
F = C − P+2,
где F ‑ количество степеней свободы (давление, температура, плотность и т. д.), С ‑ количество компонентов в системе, Р ‑ количество существующих в этой системе фаз.
Применяя это правило к однокомпонентной системе, например к воде, мы видим, что там, где все три фазы ‑ жидкость, пар и лед ‑ существуют одновременно (в точке О на фиг. 10-1),
F = C (один компонент) – P (три фазы) +2 = 0,
т.е. степеней свободы нет. Иными словами, если присутствуют все три фазы, никакое изменение в температуре или давлении невозможно. В случае двухфазной системы (жидкость + пар)
F = C (один компонент) – P (две фазы) +2 = 1,
Если две фазы находятся в состоянии равновесия в любой точке линии ОВ (фиг. 10-1), то можно определить либо температуру, либо давление (но не оба этих параметра).
Наконец, если в системе присутствует только одна фаза, например жидкость
F = C (один компонент) – P (одна фаза) +2 = 2,
(СОВ на фиг. 10-1), то вода должна оставаться в жидкой фазе, даже если переменными являются оба параметра ‑ и температура, и давление. Другими словами, жидкая фаза воды имеет две степени свободы, т. е. для определения системы в этом случае необходимо знать два условия ‑давление и температуру.
Если температура высока ‑ выше критической величины 374°С (см. фиг. 10-1), ‑ то вода может находиться только в одной фазе - парообразной, и никакое давление не способно привести к сжижению даже части этой системы. При таких сверхвысоких температурах и давлениях сосуществование двух фаз невозможно, и свойства жидкости и ее пара или газа становятся неотличимыми. Понятие о степенях свободы при сверхкритических давлениях и температурах неприменимо. При промежуточных значениях этих параметров жидкая фаза (вода) может существовать одновременно с газовой фазой (водяной пар).
Пластовые углеводороды относятся к числу крайне сложных многокомпонентных систем. Если учесть, что любая система из трех и более компонентов очень трудна для понимания, то станет ясна вся сложность изучения нефтегазовых систем, состоящих из тысяч углеводородов. Большая часть исследований, посвященных фазовым состояниям углеводородов, относится к одно- или двухкомпонентным системам, представленным простыми компонентами - метаном, пропаном и бутаном.
Фазовые диаграммы для двухкомпонентных систем, например вода ‑ нефть, можно построить, отложив по оси абсцисс молекулярный состав, а по оси ординат ‑ соответственно давление и температуру. Для изображения трехкомпонентной системы необходимо использовать равносторонний треугольник. В этом случае границы фаз изображаются линиями изобар или изотерм. Подобные диаграммы часто используются в петрологии и металлургии. Для систем, состоящих из большего чем три числа компонентов, такие простые способы построения фазовых диаграмм уже невозможны. В случае сосуществования только двух фаз, граница между ними изображается поверхностью. Если же количество сосуществующих фаз составляет три и более, границы между ними в общем случае могут быть показаны лишь линиями, т.е. соотношения между фазами необходимо представлять в виде изометрических диаграмм.
Изобарическая диаграмма на фиг. 10-2 показывает изменение состава смеси, состоящей из 60 мол. % компонента А и 40 мол. % компонента В, в зависимости от температуры при постоянном давлении.
На этой диаграмме видно, что при минимальной температуре существует только жидкая фаза. Поскольку температура смеси увеличивается при постоянном давлении (P1), объем смеси будет возрастать, но фазовое состояние не изменится до точки N. В этой точке бесконечно малое количество газа, состав которого соответствует точке Q, находится в равновесии с жидкостью. Точка N называется
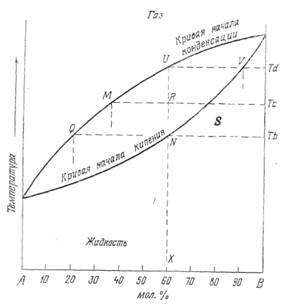
Фиг. 10-2. Изобарическая диаграмма температура ‑ состав смеси компонентов А и В.
точкой кипения, а соответствующая ей температура Тb - температурой кипения данной смеси при давлении Р1. Если температура продолжает возрастать, количество газа увеличивается, и состав как жидкости (нижняя кривая), так и газа (верхняя кривая) изменяется, хотя общий состав смеси остается постоянным. Например, в точке R, соответствующей температуре Тс, состав жидкой фазы определяется точкой S, а газовой ‑ точкой М. Относительное количество каждой фазы может быть определено по относительной длине отрезков MR и RS. В точке U в равновесии с газом остается только бесконечно малое количество жидкости, состав которой отвечает точке V. Это так называемая точка росы, а температура Тd ‑ температура конденсации для данной смеси при постоянном давлении. При любой температуре, превышающей величину температуры конденсации, может существовать только газовая фаза. Состав газа при этом тот же, что и состав первоначальной смеси. Положение и точки кипения, и точки росы изменяется в зависимости от различных переменных факторов. Например, известна только одна точка кипения (давление насыщения) и одна точка росы для данных объемов жидкости и газа при данных температуре и давлении. Если изменится величина любого из этих параметров, немедленно изменятся также и точка кипения, и точка росы. Кривая, отвечающая условиям, в которых первые пузырьки газа начинают выделяться из раствора, называется кривой точек кипения. Соответственно кривая конденсации ‑ это кривая, отвечающая таким величинам температуры и давления, при которых из газовой фазы начинают конденсироваться первые порции жидкости.
Аналогичным образом можно показать влияние на состав такой же газо-жидкостной смеси изменения давления при постоянной температуре.
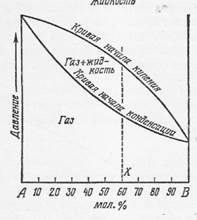
Фиг. 10-3. Изотермическая диаграмма давление - состав смеси компонентов А и В.
Если давление возрастает при постоянной температуре, характеристика смеси X, содержащей 60 мол.% компонента А и 40 мол.% компонента В, может быть получена способом, аналогичным описанному для фиг. 10-2.
Изотермическая диаграмма давление ‑ состав смеси приведена на фиг. 10-3. Обе диаграммы - изотермическую и изобарическую ‑ можно совместить и представить в виде изометрической диаграммы [3], однако этот способ в настоящей работе
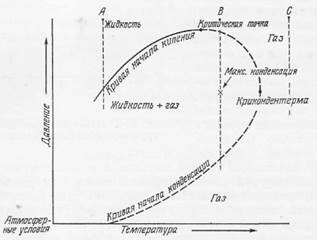
Фиг. 10-4. Диаграмма давление - температура для гипотетической двухкомпонентной системы нефть - газ, характеризующейся постоянством состава.
В нашем примере точки А, В и С могут соответствовать трем различным пластам. В пласте А смесь находится в жидком виде. При извлечении жидкости давление падает и в конце концов достиг точки кипения, вследствие чего начинает образовываться газ. Этот процесс продолжается до тех пор: пока давление не станет равным атмосферному и обе фазы, жидкая и газообразная, не разделятся в сепараторе на устье скважины. В пласте В содержится только газ, поскольку температура в на выше критической. В случае извлечения газа и снижения пластового давления ниже точки конденсации начинает быстро образовываться жидкая фаза (кривая начала конденсации). Обе фазы продолжают сосуществовать до тех пор, пока давление снова не повысится до точки росы и жидкость не растворится в газе. Явление возникновения и исчезновения жидкости в результате снижения давления при постоянной температуре называется «ретроградной конденсацией». Флюид в пласте С находится в газообразном состоянии, которое не изменяется в течение всего периода эксплуатации пласта, поскольку никакое снижение давления не ведет к изменению фазового состояния флюида.
не рассматривается.
На фиг. 10-4 приведена объединенная диаграмма давление ‑ температура для гипотетической смеси нефти и природного газа. В отличие от ранее рассмотренных диаграмма этого типа не показывает изменений состава фаз в различных условиях. При очень высоких давлениях здесь может присутствовать только одна фаза. В условиях температуры и давления, представленных точкой А, эта единственная фаза является жидкой, а в точке В - газообразной. Последнее обусловлено тем, что точка В находится выше критической температуры¹. Обе точки - А и В - могут отвечать пластовым условиям в двух различных резервуарах. При извлечении флюидов из резервуара начальное пластовое давление в нем начнет падать, что может привести к изменениям фазовых соотношений флюидов. Сопровождающее этот процесс снижение пластовой температуры, обусловленное расширением пластовых флюидов, вероятно, ничтожно мало, за исключением зоны, непосредственно окружающей работающую скважину, и им можно пренебречь, поскольку его влияние несравнимо меньше влияния изменения давления.
Если начальные пластовые условия отвечают точке А, то точка пересечения проекции этой точки с кривой начала кипения соответствует потере давления для газовой фазы. Нефть и газ сосуществуют и добываются одновременно. При снижении давления до определенной величины значительная часть газа будет удалена из пластовой жидкости, и в условиях поверхностной температуры на устье скважины (на трапе сепаратора) мы получим обе эти фазы - жидкую нефть и природный газ. Соотношение между количествами жидкости и газа, находящимися в пласте и добываемыми на поверхности, одно и то же.
Если пластовые условия соответствуют точке В, то сильное снижение пластового давления, обусловленное добычей газа из залежи, приведет в конечном счете к конденсации жидкости из газовой фазы (в точке, соответствующей давлению конденсации) и одновременному существованию двух фаз. Необходимо отметить, что в этом случае температура превышает критическую величину, но давление меньше критического. Точка, соответствующая максимальной температуре, при которой еще сосуществуют две фазы, называется крикондентермой. Если давление продолжает падать, объем сконденсированной жидкости увеличивается до максимальной величины, давление достигает точки кипения, после чего жидкость начинает испаряться, превращаясь в газ. Когда кривая конденсации пересекается второй раз, исчезают последние капли жидкости и остается только газовая фаза.
Залежь, характеризующаяся пластовыми условиями, соответствующими точке В, называется конденсатной. Конденсат добывается из нее при снижении давления и постоянной температуре. Если в пластовых условиях достигается точка росы, то образовавшаяся в залежи жидкая нефть будет неизвлекаемой в связи с тем, что, конденсируясь из газа, она адсорбируется на стенках пор в виде тонкой пленки и становится практически неспособной к движению к забоям скважин вместе с добываемым газом, который при высоком давлении должен был бы снова раствориться в этой нефти. В промысловой практике такие залежи известны, и, чтобы не допустить конденсации жидкой фазы в резервуаре, требуется применение специальных методов эксплуатации. Одним из наиболее распространенных технических приемов, направленных на предотвращение потерь жидких углеводородов при эксплуатации конденсатных залежей, является поддержание пластового давления путем закачки в залежь газа под высоким давлением. В случае очень высоких температур в пласте, соответствующих точке С на фиг. 10-4, падение давления не приводит к каким-либо изменениям в фазовом состоянии углеводородов (см. также стр. 451).
 ¹Критическая температура (Тс) ‑ это такая температура, выше которой газ ни при каком давлении не может быть превращен в жидкость. Критическое давление (Рс) ‑ давление, при котором газ находится в равновесии с жидкостью при критической температуре.
¹Критическая температура (Тс) ‑ это такая температура, выше которой газ ни при каком давлении не может быть превращен в жидкость. Критическое давление (Рс) ‑ давление, при котором газ находится в равновесии с жидкостью при критической температуре.
Можно предположить, что за геологическое время различные фазы внутри природного резервуара приближаются к состоянию статического равновесия и в значительной степени стабилизируются. Иными словами, соотношения между пластовыми флюидами приходят в соответствие с такими факторами, как температура, давление, насыщенность, характер нефти, газа и воды в этом резервуаре. Но как только один из этих факторов изменяется, равновесие тотчас же нарушается, и вся система снова начинает изменяться в сторону равновесия и стабилизации. Естественно, что пластовые условия в течение геологического времени могли неоднократно изменяться, в особенности под влиянием таких факторов, как изменение давления, минерализация пластовых вод, температура, характер нефти и газа (изменения последнего могут произойти либо в результате привноса в залежь дополнительных количеств углеводородов, либо в результате внутренних молекулярных изменений под влиянием изменений температуры и давления). Фазовое равновесие в залежи может нарушиться также и искусственным путем ‑ при извлечении из залежи флюидов. Это значит, что фазовое равновесие, установившееся в пласте, нарушается и продолжает изменяться во всех случаях, когда производится непропорциональная добыча одного или более компонентов из залежи, когда пластовое давление в процессе разработки залежи снижается или когда в пласт закачиваются вода, воздух или газ с целью поддержания пластовой энергии и увеличения добычи.
Таким образом, изменения пластовых условий и фазовых соотношений пластовых флюидов связаны с очень большим и неопределенным количеством переменных факторов. Поскольку процессы, происходящие в пласте, действительно очень сложны и характеризуются неисчислимым количеством неизвестных, можно утверждать, что наши знания об этих процессах весьма фрагментарны. Все, что нам известно в настоящее время по этому вопросу, есть главным образом результат усиливающихся исследований в области химии и физики граничных поверхностей, фазовых соотношений и нефтяного пласта, данные которых могут быть использованы с целью познания геологии природного резервуара. Однако предстоит сделать еще очень много для познания пластовых условий.
Дата добавления: 2015-06-10; просмотров: 3362;
