Окисление моносахаридов
Окисление до гликаровых кислот. В простых сахарах содержится большое число функциональных групп, которые могут быть окислены разнообразными агентами. Азотная кислота окисляет альдозы и кетозы до дикарбоновых кислот - гликаровых (или сахарных) кислот.
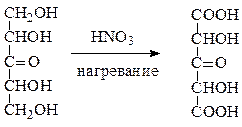
Так, из D-глюкозы образуется при этом D-глюкаровая кислота,
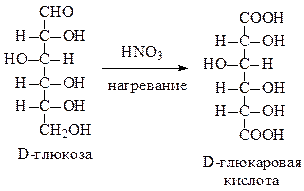
В результате подобной реакции происходит окисление первичных гидроксильных групп и альдегидных групп моносахарида.
Окисление до гликоновых кислот. Если взять более мягкий, чем азотная кислота, окисляющий реагент, окисление функциональных групп будет происходить избирательно. Бромная вода (Br2/H2O), например, окисляет только альдегидные группы альдоз до карбоксильных групп. Возникающие монокарбоновые кислоты называются гликоновыми или альдоновыми. Не редко реакцию проводят в присутствии небольших количеств оснований.
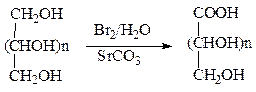
Под действием бромной воды D-глюкоза окисляется до D-глюконовой кислоты, выход которой может превышать более 75 %.
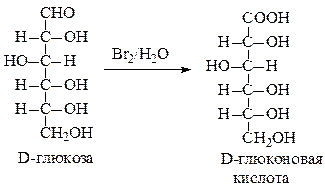
На самом деле при окислении образуется не сама гликоновая кислота, а соответствующий ей лактон. Следовательно, окислению подвергается не карбонильное, а полуацетальное соединение. Роль основания сводится к образованию алкоксид-аниона, атакующего бром. Затем происходит отщепление бромистого водорода по механизму Е2. Ниже приведен пример подобных реакций.
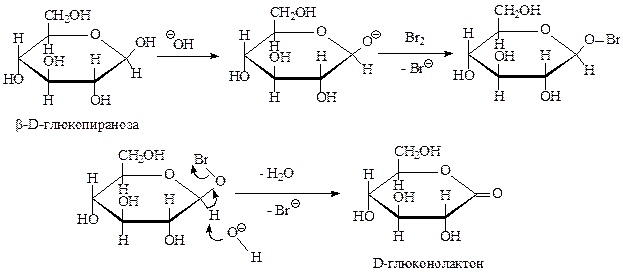
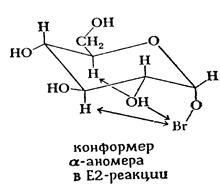
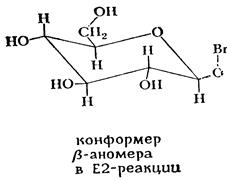
α-D-Глюкопираноза окисляется медленнее β-аномера из-за неблагоприятных аксиальных взаимодействий в том конформере α-аномера, который необходим для протекания транс-элиминирования. В конформере β-аномера, который требуется для того, чтобы шла эта реакция, подобные взаимодействия не наблюдаются. Следовательно, β-аномер нуждается в меньшей энергии активации для транс-элиминирования, чем α-аномер.
Реактивы Бенедикта, Фелинга (фелингова жидкость) и Толленса окисляют альдозы до гликоновых кислот. Каждый из этих реактивов содержит катион металла, который восстанавливается альдозами (отсюда и название этих сахаров - восстанавливающие сахара).
Реактив Толленса готовят, смешивая растворы едкого натра и нитрата серебра, в результате чего выпадает осадок оксида серебра.
2Ag+ + 2OH- = Ag2O + H2O
При осторожном добавлении водного раствора аммиака осадок растворяется и образуется ион Ag(NH3)2+ (в осадок не выпадает). Этот раствор и есть реактив Толленса.
Добавление альдозы к реактиву Толленса осаждает металлическое серебро, нередко в виде зеркального покрытия на стенках пробирки (откуда и название - реакция «серебряного зеркала»).
Фруктоза тоже дает положительную реакцию с реактивом Толленсаг хотя в ней нет альдегидной группы. Дело в том, что между глюкозой, маннозой ифруктозой существует равновесие, катализируемое основаниями. Это равновесие включает ендиол в качестве промежуточного продукта и известно под названием перегруппировки Лобри де Брюйна - ван Экенштейна.
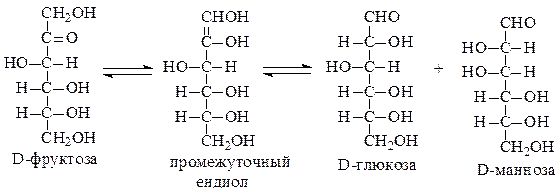
Таким образом, с реактивом Толленса на самом деле реагирует не фруктоза, а образовавшиеся из нее под действием щелочи манноза и глюкоза.
Реактив Фелингаготовят, смешивая слабокислый раствор сульфата меди со щелочным раствором виннокислого калия-натрия (соль Рошеля). При нагревании раствора в присутствии альдегида (например, альдозы) выпадает красный осадок Сu2О.
Такой же осадок выпадает в присутствии альдозы при использовании реактива Бенедикта,принцип действия которого, как и реактива Фелинга, основан на восстановлении двухвалентной меди до одновалентной и осаждении Сu2О. Единственное различие между этими реактивами заключается в том, что в растворе Бенедикта двухвалентная медь стабилизирована в щелочном растворе цитрат-ионом.
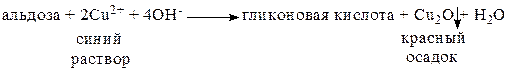
Сахара в форме гликозидов не содержат свободной альдегидной группы и, следовательно, не реагируют с мягкими окисляющими агентами.
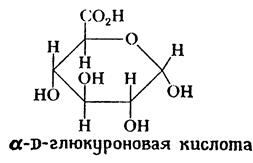
Окисление до гликуроновых кислот. Гликуроновые (уроновые) кислоты- это соединения, в которых концевая первичная гидроксильная группа моносахарида окислена до карбоксильной, в то время как карбонильная группа не претерпела никаких изменений. Их довольно трудно синтезировать в лаборатории, хотя они распространены в природных условиях, особенно D-глюкуроновая кислота.
Окислительная деградация сахаров. Окисление диолов проводится периодат. Эта реакция, которая часто используется при анализе углеводов, приведена ниже [5].
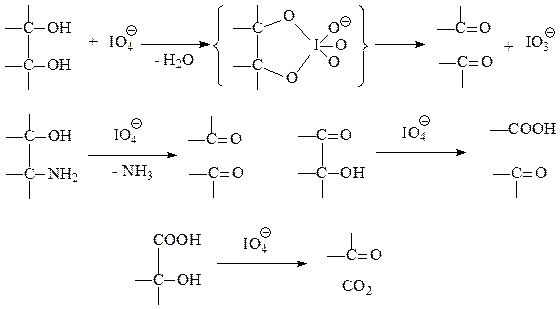
Дата добавления: 2015-04-05; просмотров: 13612;
