Полимеразная цепная реакция
Полимеразная цепная реакция (ПЦР, англ. – PCR) подразумевает определение нуклеиновых кислот (РНК или ДНК) ВИЧ в биологических жидкостях.
Принцип метода ПЦР-диагностики представлен на рис. 8.
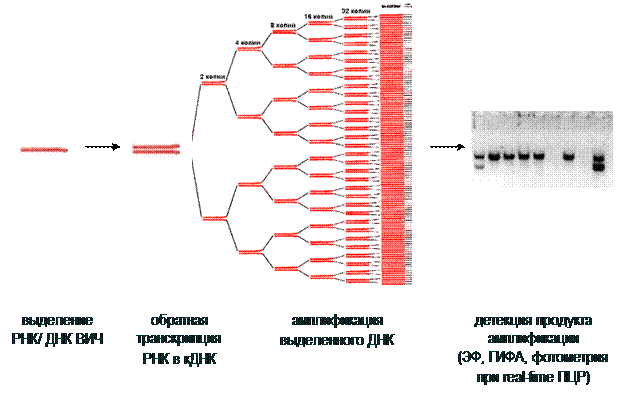
Рис. 8. Принцип постановки полимеразной цепной реакции (ПЦР)
При ВИЧ-инфекции используются два варианта ПЦР: качественная и количественная, или вирусная нагрузка (табл.3).
Таблица 3 – Характеристики качественной и количественной ПЦР, используемых для диагностики ВИЧ
| что определяет | материал для исследования | клиническое использование | |
| качественная | «ДНК-ПЦР»: наличие ДНК ВИЧ, интегрированного в геном клетки-мишени (лимфоцита) – резервуара инфекции | культура лимфоцитов крови | - определение ВИЧ-статуса в случаях, когда использование для этих целей ИФА/ИБ некорректно |
| количественная (вирусная нагрузка) | «РНК-ПЦР»: наличие РНК свободных вирионов ВИЧ, находящихся в плазме | плазма крови | - прогнозирование течения ВИЧ-инфекции у пациентов без терапии; - контроль эффективности АРТ (стартовая VL и в динамике); - выбор тактики ведения ВИЧ-позитивных беременных |
Качественная ПЦР проводится с целью определения ДНК ВИЧ в лимфоцитах крови для установления ВИЧ-статуса пациента.
Порог чувствительности выявления ДНК ВИЧ методом качественной ПЦР составляет около 5 копий на 106 клеток. Метод тем не менее считается несколько менее точным для диагностики ВИЧ-инфекции, чем ИФА/ИБ, и используется в следующих случаях:
1) когда использование ИФА/ИБ для установления ВИЧ-статуса некорректно:
§ у ВИЧ-экспонированных детей (если у ребенка первых 18 месяцев жизни выявляются антитела к ВИЧ, то неясно чьи они – собственные или материнские);
§ в период «серологического окна» (т.е. когда у инфицированного ВИЧ пациента антитела еще отсутствуют или субопределяемы – см. рис. 4): после профессиональных контактов, при наличии клиники острого ретровирусного синдрома, при тестировании донорской крови (исследование пулированных образцов);
2) для уточнения неопределенных результатов тестирования в ИФА/ИБ.
Для постановки качественной ПЦР с целью установления ВИЧ-статуса ребенка, рожденного ВИЧ-позитивной матерью, не используют пуповинную кровь, так как она может содержать материнскую кровь, а исследуют только кровь ребенка.
Положительный результат ПЦР-определения ДНК ВИЧ в первые 48 часов жизни ребенка позволяет предположить внутриутробное заражение. Вероятность обнаружения ДНК ВИЧ в первые 48 часов жизни ребенка составляет всего 17-38%. Если на первой неделе жизни ПЦР-определение ДНК ВИЧ дает отрицательный результат, а впоследствии – положительный, то считается, что заражение ребенка произошло во время родов. К возрасту 1 месяца ДНК ВИЧ обнаруживается практически у всех инфицированных детей: чувствительность составляет 98%, а специфичность – 99%.
Для постановки диагноза ВИЧ-инфекции ребенку, рожденному ВИЧ-позитивной матерью, обычно проводится двукратное ПЦР-исследование с интервалом 2-3 месяца. Получение отрицательного результата свидетельствует об отсутствии ВИЧ-инфекции, но требует подтверждения путем параллельного получения отрицательного результата в ИФА/ ИБ.
Вирусная нагрузка (ВН, англ. – VL), или количественная ПЦР, проводится с целью определения количества вирусов (РНК ВИЧ) в плазме крови пациента.
Определение вирусной нагрузки имеет значение для:
§ прогноза течения ВИЧ-инфекции (вирусная нагрузка позволяет предсказать скорость снижения количества CD4 лимфоцитов);
§ контроля эффективности проводимой АРТ в динамике (вирусологическая эффективность), вирусная нагрузка – самый важный тест для оценки эффективности терапии;
§ прогноза вероятности передачи ВИЧ (она выше при высокой вирусной нагрузке) как при профессиональных и половых контактах, так и при передаче ВИЧ от матери ребенку, и, соответственно, для выбора схемы медикаментозной постконтактной профилактики и выбора тактики ведения ВИЧ-позитивных беременных;
§ для постановки предварительного диагноза ВИЧ-инфекции пациенту, имеющему симптомы острой ВИЧ-инфекции (диагноз можно предполагать только при обнаружении высокой вирусной нагрузки – выше 100 тысяч копий/мл, и в последующем диагноз следует подтвердить стандартными методами – ИФА/ИБ).
Характеристика используемых для измерения уровня вирусной нагрузки тест-систем представлена в табл. 4.
Таблица 4 – Тест-системы для измерения уровня вирусной нагрузки, одобренные FDA [цит. по Дж. Бартлетту, 2006]
| Торговое название | Amplicor HIV Monitor 1.5 | Versant HIV-1 RNA3.0 | NucliSens HIV-1 QT |
| Производитель | Roche | Bayer | bioMerieux |
| Техника | ОТ-ПЦР | рДНК | NASBA |
| Сравнение результатов | Результаты, получаемые методом ОТ-ПЦР, сравнимы с результатами, получаемыми методом рДНК (Versant) с использованием тест-систем 2.0 и 3.0 | Результаты, получаемые методом рДНК, сравнимы с результатами, получаемыми методом ОТ-ПЦР (Amplicor) | Результаты, по-видимому, сравнимы с результатами, получаемыми методами ОТ-ПЦР и рДНК, но пока не получено достаточно данных |
| Преимущества / недостатки | • Меньше ложноположительных результатов у ВИЧ-отрицательных пациентов по сравнению с тест-системами фирмы Bayer. | • Занимает меньше времени. • Хороший динамический диапазон, но выше порог неопределяемой вирусной нагрузки. | • Может применяться для обнаружения вируса в тканях и биологических жидкостях, например, выделениях половых путей. • Самый большой динамический диапазон. |
| Динамический диапазон | • Стандартный: (Amplicor 1.5) 400-750 000 копий/мл • Суперчувствительный: (Ultra-Direct 1.5) 50-100 000 копий/мл | рДНК 3.0: 75-500 000 копий/мл* | Количественный тест на ВИЧ-1 NucliSens: 176-3 500 000 копий/мл; динамический диапазон зависит от объема |
| Подтип вируса | Тест-система 1.5: от А до G | от А до G | от А до G |
| Необходимый объем материала для исследования | • Amplicor: 0,2 мл • Суперчувствительный: 0,5 мл | 1 мл | От 10 мкл до 2 мл |
| Пробирки | ЭДТА (пробирка с сиреневой крышкой) | ЭДТА (пробирка с сиреневой крышкой) | ЭДТА, гепарин, цельная кровь, любая биологическая жидкость, МКПК, семенная жидкость, ткани и т. д. |
| Требования | Отделить плазму не позже чем через 6 часов после забора крови, перед транспортировкой заморозить при температуре -20°С или -70°С. | Отделить плазму не позже чем через 4 часа после забора крови, перед транспортировкой заморозить при температуре -20°С или -70°С. | Отделить сыворотку или плазму не позже чем через 4 часа после забора крови, перед транспортировкой заморозить при температуре -20°С или -70°С. |
* нижний порог измерений, установленный FDA, равен 50 копий/мл
Используемые для определения вирусной нагрузки тесты обычно определяют наличие РНК ВИЧ-1 субтипов В или А-G (группа М). Тесты недостаточно точны для выявления ВИЧ-1 групп N или О, а также ВИЧ-2.
Вирусная нагрузка определяется обычно в плазме крови, но некоторыми тестами ее можно определять и в других биологических жидкостях, например, в семенной жидкости, вагинальных выделениях, спинномозговой жидкости, грудном молоке, слюне.
Диапазон определяемых значений вирусной нагрузки различен для разных тест-систем. Минимальный порог определения для используемых в настоящее время в Беларуси тестов составляет 1 500 копий/мл, то есть термин «неопределяемая вирусная нагрузка» не означает отсутствия вируса в крови, а говорит о том, что его количество составляет менее порога определения для данной тест-системы (в нашем случае < 1 500 копий/мл).
Чувствительность теста составляет около 100% при острой ВИЧ-инфекции; специфичность в среднем 97%, но при вирусной нагрузке >10 000 копий/мл приближается к 100%.
Специфичность теста составляет 91-98%, поэтому тест не используется для диагностики ВИЧ-инфекции. Ложноположительные результаты у неинфицированных пациентов регистрируются в 2-9%, обычно показывая низкую концентрацию вируса (<10 000 копий/мл). Диагноз ВИЧ-инфекции, выставленный при обнаружении РНК ВИЧ в крови, должен быть подтвержден стандартными тестами – постановкой качественной ПЦР (определение ДНК ВИЧ) или постановкой ИБ (с повтором ИБ спустя 2-4 месяца после начального сомнительного или отрицательного теста).
Приведенная в табл. 5 градация уровней вирусной нагрузки является в определенной степени условной, но позволяет выделять порог возможного старта прогрессирования ВИЧ-инфекции, при регистрации которого требуется дополнительная оценка клинического статуса и количества CD4 лимфоцитов для решения вопроса о начале АРТ. Вирусная нагрузка в пределах до 5 тысяч копий/мл говорит о низком риске прогрессирования ВИЧ, порог возможного старта прогрессирования составляет > 55 тысяч копий/мл для подростков и взрослых и > 100 тысяч копий/мл (или даже более высокие значения) для детей.
Таблица 5 – Условная градация уровней вирусной нагрузки
| градация уровней | VL, копий/мл (методом RT-PCR) |
| порог определения | < 50 * < 1 500 ** |
| очень низкий уровень | 1 500 - 7 тысяч |
| низкий уровень | 7 - 20 тысяч |
| умеренный уровень | 20 - 55 тысяч |
| порог возможного старта прогрессирования ВИЧ-инфекции | > 55 тысяч у подростков и взрослых > 100 тысяч у детей |
| высокая вирусная нагрузка | > 80 - 100 тысяч |
* порог определения, достигаемый при использовании некоторых тест-систем и принятый в клинических рекомендациях по оценке эффективности АРТ
** порог определения для используемых в настоящее время в Беларуси тест-систем
Вирусная нагрузка у мужчин на фоне сохранного иммунитета может быть несколько выше, чем у женщин (до 2 раз), но при снижении количества CD4 лимфоцитов (<300 клеток/мкл) эти различия исчезают. Поэтому при оценке уровня вирусной нагрузки при принятии лечения о начале АРТ пол пациента не учитывают.
Клиническая трактовка результатов определения вирусной нагрузки сложна, так как:
§ возможны естественные колебания VL в условиях полного благополучия;
§ транзиторное повышение уровня VL могут вызвать появление острого эпизода оппортунистической инфекции или вакцинация;
§ определяемый уровень вирусной нагрузки в крови может не отражать уровень вирусной нагрузки в других тканях (например, в эпителии и выделениях из половых путей, в лимфатических узлах, в ЦНС, в ЖКТ).
Поэтому при трактовке результатов определения вирусной нагрузки следует учитывать следующее:
§ забор крови на VL следует проводить не ранее чем через 2-4 недели после исчезновения симптомов острой инфекции (если невозможно – то все заборы проводить в примерно схожем клиническом состоянии пациента) или вакцинации;
§ исследование крови следует проводить всегда одним и тем же методом в одной и той же лаборатории;
§ значимыми колебаниями VL следует считать колебания более чем в 2-3 раза (поскольку 95%CI для результатов теста составляет 0,3-0,5 lg) – например, повышение с 20 тысяч до более чем 40-60 тысяч копий/мл; при сомнениях, выросла ли VL или осталась на прежнем уровне, следует повторить анализ;
§ результаты определения VL должны заново перепроверяться перед стартом или изменением АРТ.
Существуют особенности вирусной нагрузки у детей:
§ в целом дети имеют более высокие уровни VL, высокой считается VL > 100 тысяч копий/мл;
§ при перинатальной ВИЧ-инфекции: при рождении VL обычно не определяется или низкая (до 10 тысяч копий/мл), ко 2 месяцу жизни достигает высоких значений (более 100 тысяч копий/мл), а затем в течение нескольких лет медленно снижается (в течение первых 2 лет в среднем на 0,6 lg в год, в течение следующих 4-5 лет – на 0,3 lg в год).
На основании уровня вирусной нагрузки нельзя судить о степени повреждения функции иммунной системы и о чувствительности вируса к АРВ препаратам.
Дата добавления: 2015-05-30; просмотров: 2772;
