Принцип запрета Паули
Если тождественные частицы имеют одинаковые квантовые числа, то их волновая функция симметрична относительно перестановки частиц. Но для фермионов волновая функция должна быть антисимметричной. Отсюда следует, что два одинаковых фермиона, входящих в одну систему не могут находиться в одинаковых состояниях. Обобщая опытные данные, В. Паули сформировал принцип исключения, согласно которому системы фермионов встречаются в природе только в состояниях, описываемых антисимметричными волновыми функциями (квантовомеханическая формулировка принципа запрета Паули).
Принцип запрета Паули – фундаментальный закон природы, заключающийся в том, что в квантовой системе две тождественные частицы с полуцелым спином не могут одновременно находиться в одном состоянии. Сформулирован в 1925 г. В.Паули для электронов в атоме и назван им принципом запрета, затем распространен на любые фермионы. В 1940 г. Паули показал, что принцип запрета – следствие существующей в квантовой теории поля связи спина и статистики. Частицы с полуцелым спином подчиняются статистике Ферми – Дирака, поэтому волновая функция системы одинаковых фермионов должна быть антисимметричной относительно перестановки любых двух фермионов; отсюда следует, что в одном состоянии может находиться не более одного фермиона. Принцип Паули сыграл решающую роль в понимании закономерностей заполнения электронных оболочек атома; определяет закономерность распределения электронов в атоме по оболочкам и слоям.
Состояние электрона в атоме характеризуется четырьмя квантовыми числами:
главным 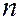 (
( 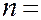 1, 2, 3, ……);
1, 2, 3, ……);
орбитальным 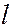 (
( 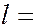 0, 1, 2, …..,
0, 1, 2, ….., 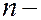 1); всего
1); всего 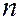 значений;
значений;
магнитным 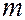 (
( 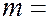
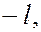 ….., 0, + 1, ….. +
….., 0, + 1, ….. + 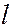 ); всего
); всего 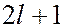
значение;
спиновым 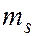 (
( 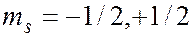 ); всего 2 значения.
); всего 2 значения.
Распределение электронов в невозбужденном атоме происходит на основе двух принципов:
1. принцип наименьшей энергии: при прочих равных условиях электрон находится в состоянии, при котором его энергия минимальна;
2. принцип запрета Паули, который может быть сформулирован для атома в следующем виде: в одном и том же атоме, не может быть более одного электрона с одинаковым набором четырех квантовых чисел 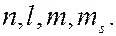 В соответствии с принципом запрета Паули электроны в атоме распределяются по слоям и оболочкам.
В соответствии с принципом запрета Паули электроны в атоме распределяются по слоям и оболочкам.
Совокупность электронов в многоэлектронном атоме, имеющих одно и то же главное квантовое число 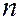 , называется электронным слоем (или электронной оболочкой). Максимальное число электронов, находящихся в состояниях, определяемых значением главного квантового числа
, называется электронным слоем (или электронной оболочкой). Максимальное число электронов, находящихся в состояниях, определяемых значением главного квантового числа 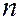 (т.е. в слое), равно:
(т.е. в слое), равно: 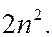
Совокупность электронов, имеющих одинаковые значения 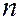 и
и 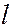 , образуют оболочку (подоболочку). Поскольку орбитальное квантовое число принимает значения от 0 до
, образуют оболочку (подоболочку). Поскольку орбитальное квантовое число принимает значения от 0 до 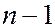 , число оболочек равно порядковому номеру
, число оболочек равно порядковому номеру 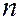 слоя. Количество электронов в облочке определяется магнитным и магнитным спиновым квантовыми числами: максимальное число электронов в подоболочке с данным
слоя. Количество электронов в облочке определяется магнитным и магнитным спиновым квантовыми числами: максимальное число электронов в подоболочке с данным 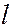 равно
равно 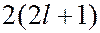 . Обозначения слоев, а также распределение электронов по слоям и оболочкам приведены в таблице.
. Обозначения слоев, а также распределение электронов по слоям и оболочкам приведены в таблице.
| |||||||||||||||
| Символ слоя | K | L | M | N | O | ||||||||||
| Максимальное число электронов в слое 2n2 | |||||||||||||||
Орбитальное кв. чис. 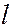
| |||||||||||||||
| Символ оболочки | 1s | 2s | 2p | 3s | 3p | 3d | 4s | 4p | 4d | 4f | 5s | 5p | 5d | 5f | 5g |
| Максимальное число электронов в оболочке |
Для полностью заполненной оболочки характерно равенство нулю суммарного орбитального и спинового моментов электронов, входящих в оболочку. Поэтому при определении орбитального и спинового моментов атома полностью заполненные оболочки можно не принимать во внимание.
Дата добавления: 2015-05-26; просмотров: 1224;
