Оптические спектры
Оптическим излучением, или светом, называются электромагнитные волны, длины которых в вакууме лежат в диапазоне от 10 нм до 1 мм. К оптическому диапазону относят инфракрасное, видимое и ультрафиолетовое излучения.
Инфракрасным излучением (ИК) называют электромагнитное излучение, длины волн которого в вакууме лежат в пределах от 1 мм до 770 нм.
Видимым излучением (видимым светом) называют электромагнитное излучение с длинами волн в вакууме от 380 до 770 нм, которое способно непосредственно вызывать зрительное ощущение в человеческом глазе.
Ультрафиолетовым излучением (УФ) называют электромагнитное излучение с длинами волн в вакууме от 380 до 10 нм.
По виду оптические спектры разделяют на спектры испускания (спектры излучения, или эмиссионные спектры) и спектры поглощения (абсорбционные спектры). По виду оптические спектры разделяют на линейчатые, состоящие из отдельных спектральных линий, соответствующие дискретным значениям 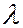 ; полосатые, состоящие из отдельных полос, каждая из которых охватывает некоторый интервал
; полосатые, состоящие из отдельных полос, каждая из которых охватывает некоторый интервал 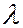 , и сплошные (непрерывные), охватывающие широкий диапазон
, и сплошные (непрерывные), охватывающие широкий диапазон 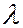 .
.
Оптические спектры возникают при квантовых переходах между уровнями энергии атомов, молекул, а также твердых и жидких тел. Спектры испускания соответствуют возможным квантовым переходам с верхних энергетических уровней на нижние, спектры поглощения – с нижних уровней на верхние.
Вид оптического спектра зависит от состояния вещества. Если при данной температуре вещество находится в состоянии термодинамического равновесия с излучением, оно испускает сплошной спектр, распределение энергии в котором дается законом излучения Планка. При отсутствии термодинамического равновесия оптические спектры могут иметь самый различный вид.
Для атомов характерны линейчатые спектры, возникающие при квантовых переходах между дискретными электронными уровнями энергии. Частота излучения, соответствующая переходу между уровнями 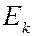 и
и 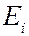 определяется соотношением:
определяется соотношением:
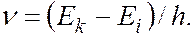
Отдельные спектральные линии в линейчатом спектре всегда имеют конечную ширину, называемую шириной спектральной линии, характеризуемую некоторым интервалом длин волн 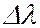 (или частот
(или частот 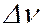 ). Ширина спектральной линии определяет степень немонохроматичности данной спектральной линии. Каждому излучательному квантовому переходу между дискретными уровнями энергии
). Ширина спектральной линии определяет степень немонохроматичности данной спектральной линии. Каждому излучательному квантовому переходу между дискретными уровнями энергии 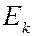 и
и 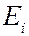 соответствует ширина спектральной линии
соответствует ширина спектральной линии 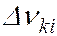 , определяемая суммой ширин уровней энергии
, определяемая суммой ширин уровней энергии 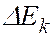 и
и 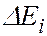 , между которыми происходит квантовый переход
, между которыми происходит квантовый переход
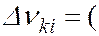
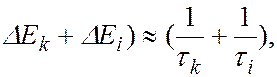
где 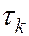 и
и 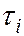 – времена жизни квантовой системы на уровнях энергии
– времена жизни квантовой системы на уровнях энергии 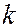 и
и 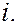
Атомные спектры обладают ярко выраженной индивидуальностью, их вид определяется не только строением атома данного элемента, но и внешними факторами – электрическими и магнитными полями, температурой и др. Атомные спектры испускания получают при возбуждении атома различными способами. Атомные спектры поглощения получаются при прохождении излучения непрерывного спектра через атомные газы или пары.
Спектральные линии в атомных спектрах подчиняются определенным закономерностям, в простейших случаях образуют спектральные серии. Каждая спектральная серия получается при разрешенных квантовых переходах с последовательности вышележащих уровней на один и тот же нижележащий уровень. Наиболее четко выделяются спектральные серии в атоме водорода. Спектры атомов щелочных металлов, имеющих один валентный электрон, схожи со спектром атома водорода, но смещены в область меньших частот; число спектральных серий в них увеличивается, а закономерности в расположении линий усложняются. Для атомов с большим числом валентных электронов спектры еще более усложняются. Под влиянием внешних электрических и магнитных полей происходит расщепление спектральных линий (эффект Зеемана, эффект Штарка).
Для простейших молекул характерны полосатые спектры. Структура молекулярных спектров различна для различных молекул и усложняется с ростом числа атомов в молекуле. Молекулярные спектры гораздо сложнее атомных спектров, что определяется большей сложностью внутренних движений в молекуле, так как кроме движений электронов относительно ядер в молекуле происходит колебательное движение ядер около положения равновесия и вращательное движение молекулы как целого. Молекулярный спектр определяется разрешенными квантовыми переходами между электронными, колебательными и вращательными уровнями энергии.
Дата добавления: 2015-05-26; просмотров: 3594;
