Трансформации малых циклов и их роль в полном синтезе
Как было показано выше, разработано множество методов, позволяющих получать циклы различных размеров, в том числе входящие в состав полициклического скелета. Размер цикла, который может быть образован с помощью того или иного метода, обычно предопределен химизмом применяемой реакции, н в силу этого вариации здесь практически исключены. Поэтому очень существенным дополнением к набору методов циклообразования являются реакции, которые позволяют изменять размер циклических фрагментов, полученных в результате той или иной циклизации. В этом отношении особенно важная роль принадлежит трансформациям циклов малого размера, трех- и четырехчленных. Такого рода системы относятся к разряду напряженных и поэтому охотнее всего участвуют в реакциях, затрагивающих скелет циклической системы. Не менее существенно то обстоятельство, что возможность получения различных систем, содержащих циклопропановые и циклобутановые фрагменты, хорошо обеспечена наличием разнообразного арсенала методов их синтеза.
Материал, который относится к этой теме, очень обширен. Ему целиком посвящены четыре выпуска Topics in Current Chemistry [Top. Сшт. Chem., 133(1986), 135(1987), 144(1988) и 155(1990)], содержащих превосходные обзоры по перегруппировкам и другим реакциям производных циклопропана и цикло бутана. Этот материал не поддается даже упрощенной классификации по какому-либо признаку. Поэтому мы вынуждены ограничиться рассмотрением лишь небольшого числа примеров трансформаций малых циклов просто для общей иллюстрации синтетической полезности этих реакций.
На схеме 2.159 представлено два синтеза природных сесквитерпенов, содержащих линейно или ангулярно сочленную систему трех циклопентано-вых фрагментов. В обоих синтезах создание дополнительного пятичленного фрагмента осуществлялось с помощью стадий [2 + 2]- циклоприсоединения и последующего расширения четырехчленного цикла.
Первая стадия синтеза хирсутена (512)[40т] — [2 + 2]-циклоприсоедине-ние циклопентена 513с метилхлоркетеном, приводящее к образованию ад-дукта 514,содержащего напряженную систему [2.3]бициююгептана. При взаимодействии хлоркетона 514с диазометаном легко протекает скелетная перегруппировка (по-видимому, через образование нестабильного цвиттер-ионного интермедиата 514а),приводящая к менее напряженной системе [3.3]бициклооктана 515.Далее из этого продукта получали алкен 516и с ним повторяли те же операции [2 + 2]-циклоприсоединения (на этот раз с дих-лоркетеном) и расширения цикла под действием диазометана, что приводило к построению требуемой системы линейно сочлененных 5-членных циклов дихлоркетона 517.Превращение последнего в целевой продукта 512уже не представляло особых сложностей.
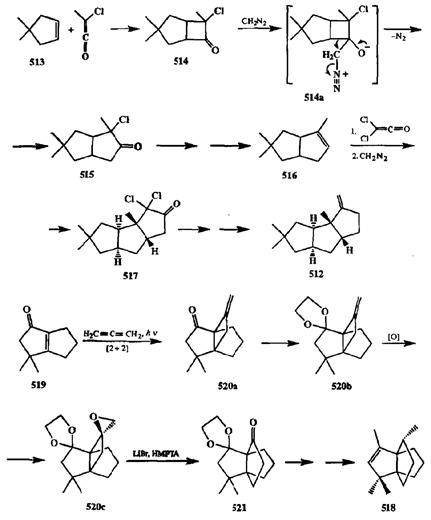 Схема 2.159
Схема 2.159
|
В синтезе модгептена (518)[40п], природного сесквитерпена, имеющего скелет [3.3.3]пропеллана, в качестве исходного соединения использовался би-циклический енон 519.Аллен-енон [2 + 2]-фотоциклоприсоединение с этим субстратом привело к трициклическому аддукту 520а, который превратили в кеталь 520Ьи далее в эпоксид 520с.Благодаря наличию в последнем напряженной [3.3.2]пропеллановой системы, содержавшей к тому же еще эпоксидный цикл, перегруппировка 520св 521протекала легко под действием бромида лития. Переход от 521к целевому продукту 518требовал введения еще двух метильных групп и создания двойной связи, что осуществлялось сравнительно легко благодаря возможности провести с полной селективностью сначала куклеофильное присоединение по одной (свободной) карбонильной группе продукта 521, а на последующих стадиях (после снятия защиты) — и по второй.
Системы, содержащие сочлененный циклобутановый фрагмент, легко подвергаются фрагментации по общей для циклов связи (естественно, при наличии в структуре подходящих заместителей). Это позволило разработать довольно простой и общий подход к синтезу соединений, содержащих циклы среднего размера, из доступных предшественников [40т]. Так, например, из диенона 522,полученного из дигидрорезорцина в две стадии по схеме ал-кен-енон [2 + 2]-фотоциклоприсоединения (ср. превращения на схеме 2.131) был с высоким выходом получен трициклическй аддукт 523(схема 2.160). Последний, благодаря наличию в его структуре р-ацетоксикетонного фрагмента, под действием водной щелочи претерпевал ретроальдольное расщепление, результатом которого было образование дикетона 524,содержавшего в структуре трудно получаемую систему [5,8]-сочлененых циклов [40о].
Хорошо известная способность циклопропанов раскрываться при действии различных электрофильных и нуклеофильных реагентов, а также в условиях каталитического гидрогенолиза, открывает множество путей для синтетически полезных трансформаций ииклопропанового фрагмента [40р]. Среди них особый интерес для
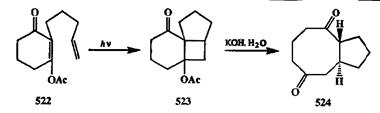 Схема 2.160
Схема 2.160
|
полного синтеза представляет последовательность превращений: метиленирование карбонильной группы/циклопропа-нирование/каталитическое гидрирование с раскрытием трехчленного цикла как метод превращения кетонной группы в гем-диметильный фрагмент. Возможность проведения такого превращения особенно важна для полного синтеза полициклических природных соединений, в структурах которых часто встречается геи-диметильный фрагмент. Так, например, в разработанном группой Мета общем подходе к синтезу трициклических циклопентаноидов (см. схему 3.22) ключевым продуктом был трициклический дикетон 525. На схеме 2.161 показана последовательность реакций, использованная для превращения этого дикетона в кетон 528, полупродукт в синтезе сесквитерпена капнеллена [40г].
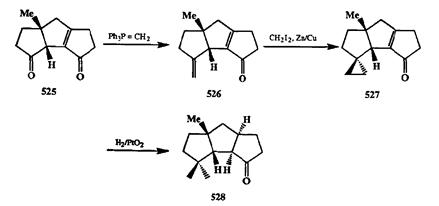 Схема 2.161
Схема 2.161
|
 Схема 2.162
Схема 2.162
|
Метиленирование дикетона 525 по Виттигу проходило селективно по более электрофильной несопряженной карбонильной группе. Циклопропани-рование продукта 526 по Симмонсу—Смиту привело к образованию аддукта 527 с высоким выходом. На следующей стадии в условиях каталитического гидрирования восстанавливалась лишняя двойная связь и протекал селективный гидрогенолиз циклопропакового фрагмента по наименее затруднен-ной связи. Для превращения полученного трициклического кстона 528 в капнеллен потребовалась всего лишь одна стадия — метиленирование по Витгигу.
В завершение данного раздела уместно рассмотреть еще одну реакцию, также имеющую прямое отношение и к химии циклопропанов, и к проблеме сужения цикла. Это перегруппировка Фаворского, конечным результатом которой является превращение а-галогенциклоалканонов 529 под действием щелочей в циклоалканкарбоновые кислоты 530, содержащих в цикле на один атом углерода меньше. Механизм этой реакции хорошо изучен. Как показано на схеме 2.162, его первой стадией является образование карбани-онного интермедиата 529а, в котором далее протекает внутримолеклярное нуклеофильное замещение, приводящее к замыканию очень напряженной системы циклопропанона 529Ь. Межмолекулярное нуклеофильное раскрытие трехчленного цикла этого интермедиата при действии гидроксид-иона и приводит к получению конечного продукта 530 [40s].
Возможность осуществлять превращения, подобные показанному в общем виде на схеме 2-162, исключительна важна в синтетическом плане, особенно для синтеза каркасных систем. Достаточно привести один пример, чтобы показать, насколько существенную роль играет перегруппировка Фаворского в синтезе такого рода структур. Таким примером может служить показанный на схеме 2.163 синтез кубана (361), первого представителя группы так называемых Платоновых углеводородов, который был выполнен в лаборатории Петгита [40t] (подробнее о проблеме синтеза углеводородов этого типа будет сказано в разд. 4.1).
Синтез начинается с реакции Дильса—Альдера между 2,5-дибромбензохиноном (531)и циклобутадиеном. Последний не может существовать в обычных условиях как таковой, поэтому в качестве синтетического эквивалента этого диена используют его комплекс с карбонилом железа 532.При обработке 532солями церия ггнерируется in situ циклобутадиен, который немедленно перехватывается активным диенофилом 531,в результате чего образуется аддукт 533.Третью «грань» будущего куба образуют с помощью фотохимического [2 + 2]-циклоприсоединения. Структура продукта этой реакции 534отличается от структуры целевого соединения лишь наличием двух дополнительных карбонильных мостиков. Для их удаления прибегают к двойной перегруппировке Фаворского, которая сразу приводит к сужению шестичленного цикла до четырехчленного и дает 1,3-кубандикарбоновую дикислоту (535). Для получения кубана (361)эту кислоту переводят в ди-/и/><?/п-бутиловый эфир соответствующей надкислоты 536,термолиз которого и дает нужный углеводород. Легко заметить, что именно возможность проводить сужение цикла с помощью перегруппировки Фаворского обусловила успешную реализацию идеи использования аддукта 534,легко получаемого в результате последователь ности двух реакций циклоприсоединения, как ключевого соединения в синтезе 361.
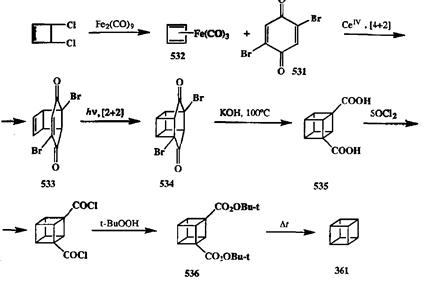 Схема 2.163
Схема 2.163
|
Перегруппировка Фаворского также успешно применялась в синтезе пентапризмана (359)и во многих других случаях.
Рассмотренные выше примеры в достаточной мере характеризуют синтетический потенциал разрыва связей С—С и скелетных перегруппировок. Совершенно ясно, что возможности осуществления такого рода превращений полезно иметь в виду при разработке путей синтеза сложных структур.
* Приведенное соотношение не является просто гиперболой. Соотношение 1 : 1000 считается вполне приемлемым в работах, направленных на создание биологически активных соединений. В последнее десятилетие это положение начинает меняться в лучшую сторону благодаря разработке принципов молекулярного дизайна, о чем пойдет речь в главе 4.
* Отметим, что на протяжении более чем полувека так и оставался нерешенным вопрос о строении димерного углеводорода, которому первоначально было приписано строение гексафенилэтана. Лишь в 1968 г, было строго доказано (с помощью метода ЯМР), что полученный Гомбергом углеводород на самом деле имеет хиноидную структуру 65б [31с]. «Настоящий» гексафенилэтан (65) так и не получен до сих пор [31d].
*Это предположение не столь гипотетично, как может показаться читателю, особенно молодому. Достаточно напомнить, что в 60-х годах усилиями некоторых ученых-чиновников Академии наук СССР работы по полному синтезу были отнесены к разряду второстепенных, что безусловно и явилось одной из причин все нарастающего отставания отечественной органической химик от мирового уровня.
*Значимость этого фактора состоит не только в общеизвестных проблемах, связанных с загрязнением окружающей среды вредными веществами. Не меньшее значение имеет сам факт появления на нашей планете многочисленных искусственно созданных веществ, что может абсолютно непредсказуемым образом сказаться на эволюции биосферы. Частным примгром, иллюстрирующим возможную роль этого нового антропогенного фактора естественного отбора, может служить хорошо известный феномен ускоренного формирования новых резистентных штаммов микроорганизмов, которое индуцируется появлением все новых и новых лекарственных средств.
** Нас могут упрекнуть в том, что мы умалчиваем о новых подходах, появившихся благодаря риработке самых разнообразных и эффективных компьютерных программ для решения задач типа «структура— свойство». Безусловно, использование этих программ может существенно сократить область эмпирического поиска и тем самым ускорить решение таких задач. Хотелось бы, однако, отметить, что эффективность этого подхода в конечном счете более всего зависит от полноты и представительности обрабатываемого банка данных, получаемых все тем же «старым добрым» способом, т.е. путем эксперимента.
* * К настоящему времени уже получено около 15 млн. органических соединений. Темы расширения этого «ассортимента» (примерно 500 новых соединений в день) пока не обнаруживает тенденции к снижению.
* Дальнейшее развитие работ в области дотированных полиацетиленов оказалось чрезвычайно успешным, свидетельством чего может служить присуждение Нобелевской премии по химии за 2000 г. А. Хигеру, А. Мак-Диармиду и X. Сиракаве за «Открытие и развитие области электропроводящих полимеров» (подробнее об этом можно прочесть в статье: Кобрянский В. М., Природа, № 1,с. 7, 2001).
** Уместно заметить, что полианилин был получен еще в 1862 г., но до недавнего времени никто и не подозревал о его довольно высокой электропроводности (200 См/см).
*Сказанное вовсе не означает, что авторы настаивают на научной значимости любой работы, результатом которой является синтез нового вещества. Именно отмеченная выше бесконечность многообразия возможных структур органических соединений заставляет особенно требовательно относится к выбору области синтетического поиска, и исследование в этой области может считаться оправданным только при условии четкой формулировки его цели.
* Бели бы это было иначе и целевые соединения отвечали термодинамическому рагнове-t сию, то проблемы синтеза практически не существовало, ибо в таком случае его можно было .осуществить, используя любой способ (например, нагревание), способствующий приведению системы в состояние равновесия.
*В схеме показано лишь образование п-бромтолуола. В действительности в этой, какивдру-гих подобных реакциях наблюдается образование по такому же механизму некоторого количества о-изомера, что, однако, не меняет общей логики нашего анализа.
* Под перициклическими понимают реакции, идущие через циклическое переходное состояние по согласованному механизму, т. е. одновременным разрывом старых и образованием новых связей.
* Энергия образования такой связи, измеренная для реакции в газовой фазе, составляет 54,3 Дж/моль — величина, весьма солидная для химической реакции.
*Характерной особенностью структуры изопреноидов, определяющей их как четко очерченныйкласс природных соединения, является то, что их молекулы могут быть построены из двухили более остатков изопрена, связанных тем или иным образом в зависимости от пути их биосинтеза, с последующими, довольно прихотливыми модификациями первоначально образующегося ациклического скелета
** Уместно отметить, что биосинтез ациклических изопреноидов также протекает по схеме, вполне адекватно описываемой как сочетание аллильного катиона с аллильным анионом. Разумеется, конкретная природа соединений, служащих эквивалентами электрофилов и нуклеофи-лов в биохимической реакции, достаточно сильно отличается от того, что мы исполыуем в лабораторной практике.
* В строгом смысле термин «реакция Гриньяра» подразумевает использование магнийорга-нических реагентов. По типу реакций Гриньяра реагируют и литийорганические производные, и к ним также относится все сказанное выше о магнийорганических соединениях. Поэтому в синтетическом смысле эти два гипа реагентов почти эквивалентны.
* Эту задачу во многих случаях решают с использованием селектиивных реакций, осуществляемых микроорганизмами, однако мы не имеем возможности рассматривать эти реакции в данной книге.
* Вообще говоря, повлиять она, конечно, может, но отсутствие существенного влияния природы защитной группы на ход последующих реакций является одним из требований к выоору защиты, пригодной для планируемого синтеза.
* На схеме использован символ о, который мы вводим для обозначения отношений эквивалентности между реагентом и синтоном (в математической логике этот символ означает эквивалентность утверждений).
Дата добавления: 2015-04-05; просмотров: 1099;
