Перегруппировка Кляйзена-Джонсона—Айрленда и гидрокси-перегруппировка Коупа
Как показано в общем виде на схеме 2.154, синтетический результат перегруппировки Кляйзена сводится к введению аллильного фрагмента по а-ато-му исходного карбонильного соединения через промежуточную стадию превращения кетона или альдегида в аллильный эфир енола 480 [40Ь]. Формально тот же результат (образование у,5-непредельного карбонильного производного 481) может быть получен по уже известной нам реакции адкилиро-вания ионных енолятов с помощью аллильных электрофилов. Однако как требования к природе субстратов, используемых в этих методах, так и механизм и условия проведения показанных реакций, резко различны, что и предопределяет синтетическое использование обоих показанных вариантов в качестве дополняющих друг друга альтернатив.
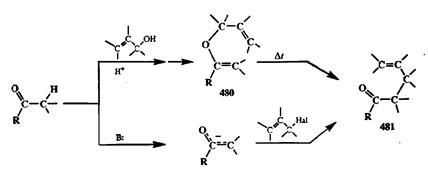 Схема 2.154
Схема 2.154
|
Одним из методов получения аллилвиниловых эфиров служит переэтери-фикация алкилвиниловых эфиров аллиловыми спиртами, катализируемая солями ртути. Мягкость условий проведения этой реакции делает возможным ее применение для получения субстратов перегруппировки Кляйзена содержащих самые разные структурные фрагменты в составе винильного или аллильного остатков. Это позволяет применять тандем реакций перс-этерификация — перегруппировка Кляйзена в качестве эффективного метода решения целого ряда синтетических задач, трудно решаемых другими способами. Некоторые типовые примеры даны на схеме 2.155.
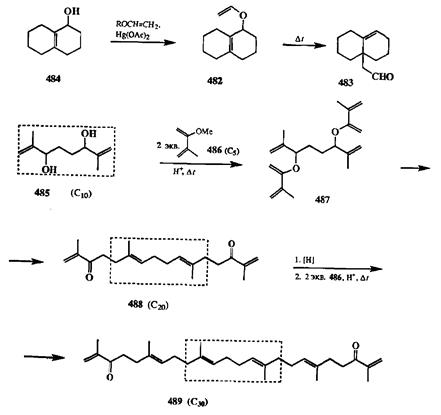 Схема 2.155
Схема 2.155
|
Превращение аллилвинилового эфира 482в альдегид 483иллюстрирует уникальность синтетического потенциала перегруппировки Кляйзена как метода получения ангулярно замещенных производных с использованием легко доступных исходных веществ, таких, как спирт 484[40с]. Получение даже такой относительно несложной структуры, как альдегид 483,другими путями было бы очень непростой синтетической задачей. Неудивительно, что реакции, подобные показанному превращению 482-»483,нашли широкое применение в синтезе различных полициклических природных соединений [40а].
Перегруппировка Кляйзена относится к типу перициклических [3.3]-сиг-матропных перегруппировок, протекающих через образование квазициклического переходного состояния. Стерическая направленность такого рода превращений зависит от наличия и природы заместителей, определяющих предпочтительную конформацию переходного состояния [40Ь]. Учет этих соображений и детальный анализ моделей переходного состояния перегруппировки Кляйзена позволили разработать оригинальный и простой метод сте-реоселективного синтеза олефиновых производных с Е-конфигурацией двойной связи с помощью этой перегруппировки. Особенно эффектный пример использования достоинств такого подхода был дан в работах Джонсона [40d] по стерсонаправленному итеративному синтезу регулярных изопренои-дов. Исходным соединением в таком синтезе служил бис-аллиловый спирт Сш (485),который по схеме переэтерификации с избытком 2-метоксиизопре-на (486)превращался в бис-эфир 487.Последний при нагревании легко претерпевает двойную перегруппировку Кляйзена, что приводит к стереоселек-тивному получению дикетона 488,в котором обе двойные связи внутри центрального фрагмента имеют требуемую Е-конгигурацию. Восстаношгение обеих кетогрупп этого продукта и повторение стадий переэтерификации под действием 486и перегруппировки Кляйзена дает аддукт 489.Последний уже содержит в готовом виде С^-скелет природного тритерпена, сквалена, который таким образом был получен по беспрецедентно короткой схеме симметричного удлинения цепи, отвечающей сборке из блоков С10 + 2 С5 + 2 С5.
Область препаративной применимости перегруппировки Кляйзена значительно расширилась, когда было найдено, что с ее помощью можно получать не только у,6-непредельные альдегиды и кетсны, но и эфиры у,5-непредельных карбоновых кислот. В последовательности превращений, разработанной Джонсоном для этой цели (схема 2.156), все стадии — получение смешанного ортоэфира 490переэтерификацией исходного аллилового эфира, образование промежуточного кетенацеталя 491и его перегуппировка с образованием конечного продукта, эфира 492— осуществляются в одной колбе, этот ор-тоэфирный вариант перегруппировки Кляйзена, известный под названием метода Джонсона—Кляйзена, является сейчас одним из самых эффективных и простых в исполнении путей синтеза прозводных типа 492[40d,e].
Дальнейшее усовершенствование этого метода — вариант, предложенный Айрлендом [40f[, в котором исходными субстратами служат легко получаемые аллиловыс эфиры кислот типа 493(схема 2.156). Обработка этих эфиров в обычных условиях генерации енолятов (действием диизопропил-амида лития, LDA) приводит к литиевым производных 494,из которых при действии триметилхлорсилилана образуются соответствующие силиловые производные 495.Перегруппировка 494 → 496протекает уже при понижен-ноитемпературе, в то время как превращение 495 → 496 осуществляется при комнатнойтеипературе. Отметим, что как в классическом варианте проведения перегруппировки Кляйзена, так и в варианте Джонсона, реакция протекает, как правило, в интервале температур 140-160˚С.
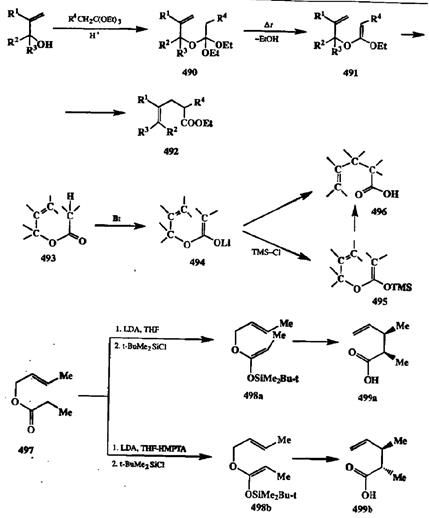 Схема 2.156
Схема 2.156
|
Вариант Айрленда, предусматривающий промежуточное образование триметилсилилкетенацеталей (495),оказался особенно удобным для стерео-контролируемого синтеза кислот типа 496.Дело в том, что конфигурацию двойной связи в промежуточно образующемся кетенацетальном фрагменте можно контролировать подбором условий образования енолятов, как это показано на схеме 2.156 на примере получения из пропионата 497 как Е-, так и Z-изомеров силилкетенацеталей 498а и 498Ь соответственно. Эти еноляты могут быть легко выделены и очищены от примесей изомеров. Последующая перегруппировка Кляйзена приводит к стереоспецифическому образованию диастереомеров 499а и 499b [40b,g].
Гидрокси-перегруппировка Коупа относится к тому же типу перицикли-ческих [3.3] сигматропных перегруппировок [40h], и се механизм также предполагает образование квазициклического шестичленного переходного состояния. Это превращение является общим методом трансформации 3-гидроксизамещенных гексадиенов-1,5 500 в 5,Б-ненасышенные карбонильные соединения типа 501(схема 2.157). Одно из достоинств этого спссо ба — возможность достаточно легкого получения требуемых субстратов, например, с помощью методов, представленных на схеме.
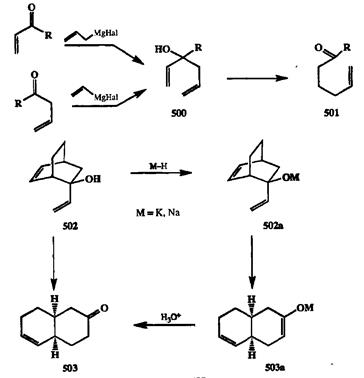 Схема 2.157
Схема 2.157
|
Однако классический вариант требовал довольно жестких условий проведения реакции (термолиз в интервале температур 150—200°С), что существенно ограничивало возможности его синтетического применения. Ситуации резко изменилась после того, как было обнаружено, что скорость этой перегруппировки сильно возрастает (в Ю10—1015 раз!), если в качестве субстрата реакции использовать не спирты типа 500,а их алкоголяты [40i]. Так, например, для превращения спирта 502в кетон 503требуется термолиз в течении нескольких часов при 170-200'С. То же превращение для калиевого алкоголята 502апротекает в кипящем тетрагидрофуране за несколько минут (интересно, что этот эффект гораздо слабее выражен для литиевого или на триевого алкоголята). Если же в среду добавить 18-краун-б, то перегруппировка калиевого алкоголята проходит уже при 0°С.
В результате разработки алкоголятного способа проведения гидрокси-перегруппировка Коупа приобрела значение действительно общего метода, исключительной синтетической важности [40J]. Ниже мы рассмотрим примеры, иллюстрирующие некоторые типичные аспекты препаративного использования этой реакции.
Основная проблема полного синтеза перипланона В (504),полового ат-трактанта таракана, — построение функционализированного 10-членного кольца. Как уже отмечалось ранее, синтез циклов подобного размера не является тривиальной задачей. Эта проблема была эффективно рещена с помощью гидрокси-перегруппировки Коупа. В разработанном группой Стилла синтезе 504[40k] непосредственным предшественником для перехода к деся-тичленной системе служил карбинол 505,получение которого из циклогек-сенона 506было осуществлено с помощью короткой последовательности несложных превращений (схема 2.158).
Перегруппировка 505протекала без осложнений и с хорошим выходом привела к продукту 507.Наличие в последнем заместителей и двух двойных связей в требуемых положениях позволило далее получить не только 504,но и использовать тот же предшественник 507для синтеза еще двух диастереомеров 504,что было необходимо для подтверждения стереохимии природного продукта {см. разд. 1.4). Уместно отметить, что во втором синтезе 504,осуществленном несколько позднее по совершенно другой схеме [401], построение 10-членного цикла также проводилось с помощью гидрокси-перегруппировки Коупа.
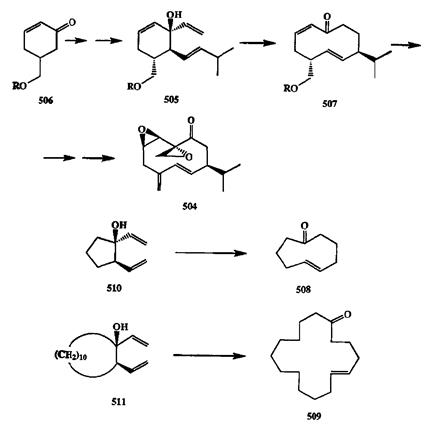 Схема 2.158
Схема 2.158
|
Превращение 505-> 507представляет собой лишь один из примеров общей реакции расширения циклов 1,2-дивинилциклоалканолов в циклоалке-ноны с увеличением размера цикла на четыре звена. Этот путь часто применяется на практике, как это проиллюстрировано на примере синтеза цикло-ноненона (508)и циклогексадеценона (509)из 1,2-дивинилциклопентанола (510)и циклододеканола (511)соответственно [40j] (схема 2.158).
Дата добавления: 2015-04-05; просмотров: 2400;
