Синтез как поиск (цель бесспорна, но не однозначна).
Синтез природных веществ, в том числе обладающих полезными свойствами, — это лишь одна, наиболее очевидная, но далеко не единственная задача органического синтеза. Как показывает весь опыт органической химии, вещества, обладающие полезными свойствами, могут быть получены не только путем копирования «изделий» Природы. Очень часто практически полезные вещества получаются в результате исследований, совершенно не связанных с синтезом природных соединений. Здесь, однако, возникает серьезная проблема, а именно: какие критерии могут быть положены в основу выбора конкретной цели синтеза и т? какой степени предсказуемы свойства ранее неизвестного соединения? В действительности, многие свойства вещества могут быть надежно предсказаны a priori просто из анализа его структурной формулы. Так, не очень трудно четко указать на некий минимальный набор структурных элементов, которые должны присутствовать в молекуле вещества для того, чтобы оно обладало, скажем, свойствами красителя, душистого или взрывчатого вещества, инсектицида, клея, пластификатора или даже лекарства определенного спектра действия. Предсказания такого рода могут быть . сделаны как на о сновании аналогии с уже имеющимися данными, так и на основе серьезного теоретического анализа. Однако наиболее общим и устойчивым свойством рекомендаций, полученных в результате такого анализа, является их неоднозначность. Покажем сказанное на ряде примеров.
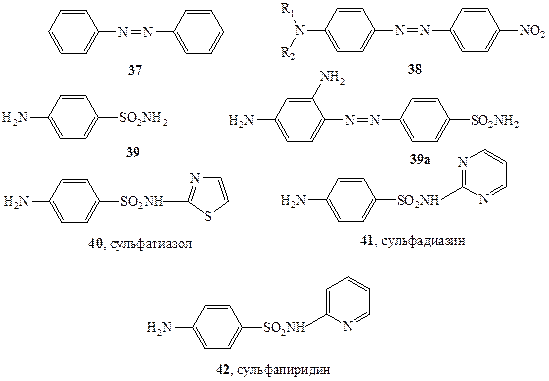 Схема 1.12
Схема 1.12
|
Вероятно, исторически первой областью органической химии, которая быстро и уверенно пошла по пути целенаправленного создания веществ с заранее заданными свойствами, была химия органических красителей. Здесь очень рано были сформулированы эмпирические правила (впоследствии превратившиеся в строгую теорию), связывающие структуру молекул с цветом вещества. В основе этих представлений лежит понятие о хромофоре — группировке атомов, ответственной за характерное для вещества поглощение света определенной дайны волны. Одним из распространенных хромофоров синтетических красителей является диарилазогруппа, присутствующая, например, в молекуле азобензола (37, схема 1.12). Подробно изучено влияние других группировок, связанных с этим хромофором, на спектральные характеристики вещества и, следовательно, на его цвет. Так, родона-чальное соединение этого ряда, 37, имеет сравнительно слабую оранжевую окраску, в то время как азосоединения общей формулы 38, содержащие диалкиламино- и нитрогруппы в пара-положениях, окрашены в ярко-красный цвет. Для всех соединений этого ряда, отличающихся лишь вариацией алкильных остатков R1 и R2, можно уверенно предсказать, что для них общими будут красный цвет и слабоосновные свойства (из-за наличия аминогруппы), а также способность изменять цвет в зависимости от рН среды.
Следовательно, если задача будет сформулирована как синтез ярко-красного азокрасителя с основными свойствами, то теория приведет нас к структуре 38, но ничего не скажет о природе алкильных групп. Поэтому исследователь окажется перед необходимостью выбора из неопределенно большого числа близко родственных, но различных соединений. При этом ему придется .учесть ряд дополнительных соображений. Так, от структуры алкильных групп будут зависеть такие характеристики веществ ряда 38, как степень основности, растворимость в воде и органических растворителях, температура плавления, способность к связыванию с поверхностью той или иной ткани, а также термо- и светостойкость. Все эти особенности уже не могут быть а priori предсказаны сколько-нибудь точно. Поэтому в подобных случаях даже после тщательного анализа, как правило, остается несколько почти равноценных структур, и химику придется синтезировать их все. И только лишь после подробного изучения свойств всех этих соединений можно окончательно выбрать те немногие из них, которые отвечают заданным практическим требованиям.
Эмпирический выбор перспективного соединения среди большого числа родственных кандидатов особенно характерен для работ по созданию новых лекарственных и вообще биологически активных препаратов. Здесь теория (чаще простая эмпирика) позволяет лишь предположить (но отнюдь не гарантировать!), что те или иные соединения, содержащие определенный набор структурных фрагментов, будут проявлять желаемую активность. Множество же других важнейших особенностей будущего лекарства, таких, как, токсичность, способность накашшватъся в организме или, наоборот, быстро выводиться из него, возможные краткосрочные или долговременные побочные эффекты, комплекс физико-химических свойств, обуслоа^ивающих различные возможности введения в организм и устойчивость при хранении и стерилизации, совместимость с другими лекарственными препаратами и многие другие, почти не поддаются априорной оценке. Поэтому после обнаружения перспективной биологической активности того или иного вещества, выделенного из природного источника или синтезированного в лаборатории, всегда следует серия работ по синтезу ряда его аналогов и сравнительное изучение всего комплекса их свойств, существенных для оценки Возможностей их практического использования.
Классическим примером может служить история создания сульфаниламидных препаратов [23]. Первоначальным стимулом к изучению этих производных явилось наблюдение, что наличие сульфаниламидной группировки в молекуле азокрасителя резко увеличивает его способность связываться с шерстяными волокнами. В то время считалось также, что поскольку стенки бактерий состоят в основном из белковых молекул (что совершенно ошибочно!), то сульфаниламиды могут активно связываться и со стенками бактерий и таким образом ингибировать их рост. В ходе дальнейших исследований совершенно случайно была обнаружено, что сульфаниламид 39а, «красный пронтозил» (схема 1.12), обладает удивительно высокой активностью против Стрептококковой инфекции на мышах. Напомним, что в те времена (1932 г.) не было эффективных лекарственных средств против бактериальной инфекции. Наиболее удивительной особенностью лекарственного действия 39а было то, что препарат был очень активен в испытаниях на животных in vivo, но его активность падала почти до нуля при стандартных тестах на культурах бактерий in vitro. Разгадка этой тайны была вскоре найдена. Оказалось, что 39асам по себе неактивен по отношению к стрептококкам, но в организме мыши он претерпевает восстановление (хорошо известная реакция азосоединений), давая сульфаниламид (39), который и является активным бактерицидом.
Вслед за этим открытием последовал настоящий взрыв синтетической активности, и к 1947 г. было получено и испытано в качестве потенциально полезных лекарственных препаратов более 5000 сульфаниламидов. В результате столь широкого скрининга удалось отобрать примерно 100 соединений, обладающих желаемым комплексом свойств. Из них менее дюжины оказались в конце концов практически пригодными в качестве лекарств, а такие, как, например, соединения 39-42 (схема 1.12), до сих пор находятся в арсенале средств борьбы с бактериальными инфекциями.
Понятно, что, если возможно четко установить, какой именно структурный фрагмент ответственен за биологическую активность соединения (как, например, сульфаниламидная группа в соединениях 39—42), поиск соединения, способного стать эффективным лекарственным препаратом, резко ускоряется. Однако лишь в очень редких случаях ситуация столь проста и, как правило, зависимость структура — активность имеет гораздо более сложный характер. В качестве примера рассмотрим некоторые данные по биологической активности стероидных соединений.
Первый стероид, холестерин (43, схема 1.13), был выделен еще в XVIII веке из камней желчного пузыря. Никакой биологической активности этого соединения в то время обнаружено не было. С тех пор еще сотни стероидных соединений были выделены из природных источников, и многие тысячи их аналогов синтезированы в лаборатории. Спрашивается, зачем это надо было делать? Эту проблему проще всего проиллюстрировать, если сравнить структуры некоторых биологически активных соединений этого класса, например 43-50.
Легко заметить близкое структурное родство этих соединений — все они содержат одну и ту же тетрациклическую систему 51,так называемое пергид-роциклопентанофенантреновое ядро. Тем не менее их конкретные функции в живых организмах разительно различаются. Холестерин (43) присутствует в значительных количествах (его нормальное содержание в организме взрослого человека составляет бол ее 0,2 кг) практически во всех тканях как составная часть липидной мембраны. Он также пользуется дурной славой из-за своей роли (может быть, не вполне заслуженной) в развитии коронарных заболеваний. Эстрон (44) и тестостерон (45) являются, соответственно, женским и мужским половыми гормонами млекопитающих. Кортизон (46) относится к числу гормонов коры надпочечников и обладает, помимо прочего, Мощным противовоспалительным действием. Альдостерон (47) является гормоном, регулирующим солевой обмен, а дигитоксигенин (48) — компонентом дигиталиса, традиционного лекарства «от сердца», выделяемого из некоторых целебных трав, например, наперстянки Digitalis purpurea (отметим, что сходными лекарственными свойствами обладает также близкий по строению строфантидин (48а), рамнозид которого, конваллотоксин, явля-ется действующим началом обычного ландыша Convallaria majaiis). К этому ft списку можно добавить ранее уже упоминавшиеся гормон окукливания на-оекомых, экдизон (9) и половой аттрактант водоросли 30.
Природные стероидные соединения, как правило, выполняют множество различных функций в организмах. В медицине же обычно желательно иметь лекарство, обладающее некоторым строго определенным набором фармакологических свойств с минимумом побочных эффектов. Однако даже на примере довольно ограниченной выборки стероидных соединений, представленной на схеме 1.13, легко убедиться в невозможности установления какой-либо однозначной зависимости между их биологической активностью и наличием того или иного структурного фрагмента в молекулах этих веществ. Так, гидроксильная группа при С-3 имеется в соединениях 9, 30, 43, 44,48, 48а и 49, в то время как 45—47 и 50 содержат при этом центре карбонильную группу. Дополнительные заместители при С-17 имеются в структурах 9, 30,43 и 46—50. Очевидно, что наличие этих структурных особенностей в молекулах упомянутых выше природных веществ или их синтетических аналогов само по себе не дает возможности предсказать характер их биологического действия. Поэтому единственный реальный способ решения проблемы создания стероидных препаратов с заданным комплексом свойств — это синтез огромного числа аналогов природных соединений и комплексное исследование особенностей их биологического действия.
 Схема 1.13
Схема 1.13
|
Синтетические исследования в области стероидов развивались по двум направлениям: полный синтез природных соединений и их аналогов и поиск путей трансформации доступных природных стероидов в практически важные вещества. В результате этих исследований лабораторным путем были получены практически все важнейшие представители этого класса природных соединений, а также их многочисленные аналоги, отвечающие почти всем мыслимым модификациям базовых структур. Среди выдающихся по своей практической значимости достижений в этой области следует упомянуть частичный синтез кортизона (46) из легко доступной холевой кислоты (49). Это превращение первоначально включало 37 стадий и приводило к получению нужного соединения с очень малым общим выходом (Саррет, 1946) [24а]. Трудно было даже предполагать, что этот путь может иметь какое-либо практическое значение. Однако менее чем через 3 года схему синтеза удалось значительно упростить, поднять на несколько порядков суммарный выход в этом превращении и наработать на пилотной установке около 1кг кортизон а (46), количества вполне до статочного для проведения клинических испытаний этого важного лекарства [24Ь].
На протяжении нескольких десятилетий стероиды оставачись в числе важнейших целей органического синтеза [24с]. Благодаря интенсивным исследованиям в этой области не только удалось сделать доступными для практического использования в медицине все стероидные гормоны, но и в значительной степени прояснить механизм их биологического действия. В частности, именно результаты таких исследований позволили, наконец, разработать эффективный подход к медицинскому контролю рождаемости — одной из наиболее жгучих проблем современного мира. В настоящее время сотни миллионов женщин во всех странах мира пользуются оральными контрацептивами, созданными на основе соединения 50 (the Рill) — синтетического аналога природного гормона прогестерона. Социальные последствия внедрения в практику этого препарата огромны, и, наверно, нелегко подобрать еще один пример того, как появление на планете всего лишь одного нового соединения могло повлиять на характер жизни значительной части человечества.
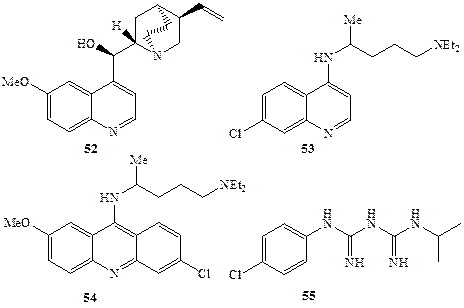 Схема 1.14
Схема 1.14
|
О важных результатах других синтетических исследований в области химии стероидов мы еще неоднократно будем говорить в последующих главах нашей книги.
Неменее интересна и история развития синтетических исследований в области простагландинов. Уникальность биологических функций этого класса соединений и крайняя ограниченность природных источников их выделения с необходимостью требовали осуществления полного синтеза этих соединений, например, ПГЕ1 (5, схема 1.2)]. По сути дела успехи медико-биологических исследований, направленных на выяснение функций этих регуляторов, были в очередь обусловлены успешным решением задачи их синтеза. Не менее актуальной была задача синтеза разнообразных аналогов этих соединений, что было обусловлено не только крайне низкой стабильностью природных простагландинов, но также тем, что последние выполняют множество самых различных функций в регуляции жизнедеятельности организма. За короткий срок удалось синтезировать несколько сотен стабильных аналогов простагландинов, среди которых и были найдены вещества узко направленного спектра действия, удовлетворяющие требованиям их практического использования [5]. Рассмотрим еще один пример несколько иного плана. Начало истории антималярийных средств датируется серединой XVI в., когда миссионер-иезуит в Перу выяснил, что в качестве эффективного средства борьбы с малярией Индейцы используют кору хинного дерева. В 1834 г. Пеллетье выделил активное начало этого средства, хинин (52, схема 1.14), но его строение было установлено лишь в XX в. Интересно, что первая попытка синтеза хинина была предпринята 18-летним Уильямом Перкиным (впоследствии ставшим знаменитым химиком-синтетиком) в 1856 г., т. е. во времена, когда само представление о том, что молекула может иметь какое-то определенное строение, собственно еще только начало складываться в сознании химиков. Зная только брутто-формулу хинина, Пtркин предположил, что окисление смеси толуи-дина и аллилбромида азотной кислотой даст хинин. Эта дерзкая попытка, конечно, провалилась, но в результате реакции вместо хинина Перкин получил первый синтетический краситель, мовеин. В дальнейшем предпринимались более осмысленные попытки полного синтеза хинина, увенчавшиеся успехом лишь в 1948 г. Параллельно этим работам также проводились поиски более дешевых средств против малярии. Были получены и испытаны тысячи возможных кандидатов на эту роль, иногда имеющих более чем отдаленное сходство с хинином. Некоторые из них, такие, как хлорохин (53), мепакрин (54) или прогуанил (55) (схема ] .14), нашли широкое применение в медицине как эффективные заменители хинина [25а].
Могло показаться, что тем самым проблема борьбы с малярией была окончательно решена. Однако, как это часто бывает в химиотерапии, широкое использование противомалярийных средств привело к появлению мутировавшего штамма Plasmodium falciparum — паразита, вызывающего малярию, — и этот новый штамм оказался резистентным к этим лекарственным препаратам. Возникла проблема создания препаратов нового поколения и снова, как это ни парадоксально для второй половины XX в., решение помогли найти средневековые рецепты народной медицины, на этот раз китайской. Еще в 1596 г. известный китайский целитель-травник Ли Шичен в трактате «Compendium Materia Medica» описал использование для лечения малярийной лихорадки экстракта растения кинхао, идентифицированного уже в наше время как полынь однолетняя (Artemisia annua). В конце 1970-х годов активный компонент этого народного средства был выделен, и его строение было установлено [25Ь]. Это вещество, терпеноид артемизин (56) (схема 1.15), содержащий редко встречающийся в структурах природных соединений эндопероксидный фрагмент, оказался именно тем лекарственным средством, которое так было необходимо к этому времени. Действительно, 56 проявлял очень высокую активность (излечение наблюдалось в 99% случаев) как раз по отношению к тем штаммам R. falciparum, которые были резистентными по отношению к хлорохину (53); гболее того, он оказывался эффективным даже против церебральной малярии — -поздней и обычно летальной фазы заболевания. Однако практическое применение соединения 56 было затруднено, поскольку это вещество мало растворимо в воде, химически неустойчиво и к тому же довольно дорого. На помощь РВНОВЬ пришел органический синтез. Полный синтез артемизина не был уж очень сложной задачей, но тем не менее реализованные к настоящему моменту -схемы его получения (см., например, ссылки в [25с]) вряд ли имеют перспективы практического использования. Однако благодаря интенсивным синтетиче-кжим исследованиям в этой области удалось не только отработать эффективные методы создания эндопероксидного фрагмента, ключевого элемента структуры .56, но и получить достаточно представительный набор его аналогов. Первич-•иые испытания показали, что некоторые из стабильных аналогов, такие, как, например, соединения 57 и 58, даже более активны в тестах in vitro, чем 56 [25d]. ••т Большая часть синтетических исследований, упомянутых в настоящем разделе, обычно классифицируются как «синтез потенциально полезных веществ». В проблемах этого типа, не имеющих однозначного ответа, химик приучается мыслить не только в терминах единичных целевых структур, а ско-/рее категориями больших серий родственных соединений. Поэтому особое значение приобретает разработка достаточно общих синтетических схем, до--кускающих получение наборов соединений, отличающихся закономерными вариациями структурных параметров. Именно наличие таких наборов служит основой для установления корреляций «структура — свойство», без чего, конечно, невозможно вести рациональный поиск оптимальной (для данной цели) структуры. Иными словами, это стиль систематического поиска, трудоемкий, иногда даже скучный, но пока неизбежный. И хотя нередко из тысячи синтезированных разными исследователями соединений «в дело» пойдет лишь одно, нельзя считать, что 999 других были получены напрасно: ведь это одно было выбрано из всей тысячи*! Без всего массива синтезированных и изученных соединений эта оптимальная структура вряд ли была найдена, ибо ве -роятность ее случайного обнаружения не превышает 1: 1000.
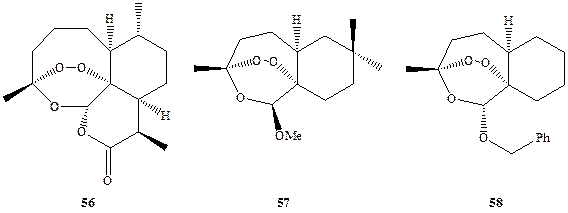 Схема 1.15
Схема 1.15
|
Дата добавления: 2015-04-05; просмотров: 1473;
