Цель однозначна, но не бесспорна
Однако важность того или иного направления в науке чаще всего не может быть оценена столь прямолинейно только по критерию немедленной полезности конкретных научных исследований. На протяжении всей истории органической химии синтетики стремились синтезировать самые различные соединения, выделяемые из живых организмов, часто вне видимой связи с их реальной или хотя бы потенциальной полезностью. Это очень устойчивая тенденция и можно утверждать, что она только усилилась за последние десятилетия. Если раньше иногда приходилось затрачивать десятилетия на осуществление таких синтезов, то сейчас разрыв между открытием нового природного соединения (а такие открытия совершаются в буквальном смысле слова ежедневно) и его полным синтезом сократился до немногих лет, а иногда и месяцев. Законно спросить, зачем делаются подобные синтезы, в чем смысл и значение получения в лаборатории вещества, которое уже было синтезировано в Природе?
Конечно, справедливо утверждение, что во многих случаях сложность и нетривиальность структур природных соединений воспринимаются сами по себе как вызов созидательным способностям Человека и, конечно, для ученого невозможно не принять этот вызов. «Почему Вам столь необходимо взойти на Эверест?» — спросили Мэллори, легендарного английского альпиниста 20-х годов. «Потому, что он есть!» — был ответ, Однако помимо подобного, может быть несколько романтического, стимула, существует также еще вполне конкретная мотивация необходимости синтеза природных соединений. Дело в том, что живая Природа ничего не делает просто так, для «забавы» — ведь биосинтез всегда сопряжен со значительными энергетическими затратами и, если его результатом является получение абсолютно бесполезного соединения, то организм-продуцент не имеет шансов выжить в процессе естественного отбора. Поэтому смело можно принять как аксиому, что все, что синтезируется организмами, так или иначе связано с обеспечением их жизненно важных функций, и, следовательно, не может не быть важным и для жизни человека. Это может показаться слишком общим или даже банальным утверждением, но на самом деле по мере эволюции наших знаний нам постоянно предъявляются все новые и вполне конкретные доказательства того, насколько оправдано такое отношение к химии природных соединений. Покажем это на некоторых примерах.
Среди множества природных соединений существует обширный класс изопреноидов (или терпеноидов), включающий тысячи структурно различных соединений, которые объединены единством пути биосинтеза из небольшого числа ключевых предшественников. Роль некоторых соединений этого класса, таких, как витамины А и D или стероидные гормоны, уже давно известна: они выполняют важнейшие регуляторные функции в организмах млекопитающих. Также понятна практическая полезность ряда других издавна известных изопреноидов, как, например, камфоры, ментола или каучука. Однако долгое время ничего конкретного не было известно ни о функциях, ни о полезных свойствах еще сотен природных соединений этого класса. В результате к 50-м годам XX в. сложилось мнение, что большинство изопреноидов, например растительного происхождения, образуются в живой клетке как физиологически инертный балласт для связывания отходов метаболизма (вторичные метаболиты). При этом как-то даже не ставился такой вопрос: а почему все-таки организму потребовалось ценой значительных затрат энергии синтезировать те или иные, иногда очень сложные структуры, если их единственное назначение — обеспечивать функционирование системы удаления «шлаков»? В те времена могло показаться, что лишь профессиональный педантизм и отсутствие воображения заставляют химиков вести нескончаемую работу по поиску и выделению, изучению строения, а также еще и синтезу все новых и новых природных изопреноидов. Типичная «инвентаризация неликвидов, числящихся на балансе природы» — вот мнение, которое авторам доводилось слышать от некоторых ученых-функционеров, откоторых, к сожалению, зависело распределение средств на научные исследования.
Однако уже в 1960-х годах эти представления пришлось радикальным образом пересмотреть. В частности было установлено, что не только млекопитающие, но насекомые и даже растения широко используют изопреноиды в качестве гормонов. Так, например, одно из поразительнейших биологических явлений, метаморфоз насекомых — возникновение взрослой особи из личинки через ряд промежуточных стадий, — контролируется тщательно согласованным действием ряда гормонов, вырабатываемых соответствующими железами. Одна из таких парных желез, так называемые прилежащие тела (corpora allata), выделяет ювенильный гормон (ЮГ) (8, схема 1.3), который способствует развитию личиночной стадии насекомого. В определенный момент секреция этого гормона падает и резко возрастает секреция другого гормона, экдизона (9), вырабатываемого проторакалышми железами, что прекращает рост личинки и «запускает» последующие стадии метаморфоза, приводящие в конечном счете к взрослой особи. Если в этот момент в организм личинки ввести извне некоторое количество ЮГ, то метаморфоз не наступает, и она продолжает просто расти в размерах, давая, в конце концов, гигантскую, но нежизнеспособную особь.
Оба эти гормона (8 и 9) являются модифицированными изопреноидами [8а]. Самый богатый природный источник ЮГ (8) — брюшной сегмент самца бабочки павлиноглазка Hyalphora cecropia — содержит не более 1—2 мкг на особь. Тем не менее, 8 довольно быстро стал доступным соединением благодаря тем огромным усилиям, которые были затрачены на его полный синтез [8b]. Выяснение роли и успешный синтез ЮГ вызвали целую лавину исследований, направленных не только на изучение механизма действия этого вещества, но и на создание многочисленных его синтетических аналогов, некоторые из которых нашли практическое применение как инсектициды нового поколения.
 Схема 1.3
Схема 1.3
|
Некоторые терпеноиды растений также выполняют жизненно важные функции гормонов роста и развития. Так, из метаболитов Gibberella fujikuroi — гриба, вызывающего аномальный рост и гибель рисовых побегов, — был выделен дитерпен гибберелловая кислота (10). Вскоре было найдено, что кислота 10 и ее многочисленные аналоги, гиббереллины (известно свыше 40 природных соединений этого типа), широко распространены среди высших растений [9а]. Наиболее характерный физиологический эффект гиббереллинов — ускорение роста стебля за счет как деления, так и растяжения стенок клетки. Но, как и в случае большинства других гормонов, действие гиббереллинов не ограничивается только этим эффектом, и они принимают участие еще во множестве событий развития и роста растений. Синтез гиббереллина 10, выполненный группой Кори [9b], относится к числу выдающихся достижений органической химии. Хотя этот синтез включал более 40 стадий и, конечно, не имеет перспектив практического использования, но вряд ли кто-нибудь может усомниться в его целесообразности, поскольку целью синтеза было получение соединения, являющегося одним из важнейших регуляторов жизнедеятельности организмов всего царства растений.
Другой терпеноид, абсцизин (11) [10], также выделенный из большого числа растений, играет роль антагониста гиббереллина. Действительно, было обнаружено, что в присутствии 11 подавляется рост побегов и инициируется образование «спящих» почек. Таким образом, переход от фазы активного роста в условиях длинного дня к фазе «сна» в условиях короткого дня контролируется балансом содержания в клетках соединений 10 и 11.
Богатейший ассортимент изопреноидов обнаружен среди метаболитов растений и грибов. Среди них встречаются очень сильные токсины, соединения с противоопухолевой и противовоспалительной активностью и антибиотики различного спектра действия. Как правило, очень мало или вообще ничего неизвестно о том, какова роль этих веществ в жизнедеятельности организмов-продуцентов. Однако тот факт, что соединения этой группы прояшшют столь Широкий спектр биологической активности по отношению к другим биологическим объектам, не может не рассматриваться как указание, по крайней мере косвенное, на их участие в регуляции каких-то биологических функций, существенно важных для организмов-продуцентов. Это утверждение может показаться чисто декларативным, но далее мы приведем примеры того, какие нетривиальные биологические функции могут быть обнаружены, если рассматривать тот или иной организм не как изолированную особь, как это делалось еще сравнительно недавно, а во всем комплексе его взаимоотношений с другими членами биологического сообщества, т. е. как часть экосистемы.
Ни один из живых организмов не может существовать вне связи с другими живыми существами, образующими данный биоценоз. Поэтому для действительного понимания функций природных соединений необходимо рассматривать также возможность их участия в качестве медиаторов, регулирующих тем или иным образом взаимоотношения данной особи как с особями того же вида, так и с совершенно иными организмами данного сообщества. Пока мы находимся еще в самом начште пути к пониманию этих важнейших аспектов химической экологии. Тем не менее, уже накопилось множество фактов, однчозначно свидетельствующих о наличии и жизненной важности функционирования химического канала связи на всех уровнях организации биологических систем.
Для соединений, выступающих в роли химических сигналов (т.е. переносчиков информации между организмами), предложен термин феромоны или экзогормоны (более общий английский термин — semiochemicats). В роли такого рода сигналов в живой природе могут использоваться соединения практически любых классов, различных по сложности и характеру функционализации, в том числе и изопреноиды, о которых шла речь выше. Ниже будут рассмотрены некоторые типичные примеры, призванные показать разнообразие структур этих веществ и выполняемых ими функций,
По-видимому, именно насекомые за время своей эволюции смогли выработать наиболее изощренную систему химической сигнализации, играющую огромную роль в их жизни. Действительно, с помощью феромонов они способны передавать информацию о присутствии особей того же или иного вида (сигналы узнавания наподобие армейских сигналов опознания «свой — чужой»), о местонахождении самца или самки (половые аттрактанты), о приближении опасности (феромоны тревоги), о наличии источника пищи и маршруте к нему (феромоны агрегации и маркеры следа) и о многом другом.
Эффективность взаимодействия между особями насекомых на больших расстояниях действительно поразительна. Самка бабочки тутового шелкопряда Bombyx mori испускает атграктант, бомбикол, который способен вызывать ответную реакцию самца на расстоянии до 10 км! Невероятно трудная работа по выделению этого соединения была выполнена Бутенандтом и сотр. [Па], которым после нескольких лет кропотливой работы удалось выделить всего лишь 3 мг бомбикола путем обработки 31000 желез, каждая из которых была удалена из девственной самки Bombyx mori [ 1 la]. Структура этого вещества оказалась на удивление простой — (10E,12Z)-гсксадекадиен-10,12-ол-1 (12) (схема 1.4), и его синтез потребовал всего лишь нескольких недель [11b].
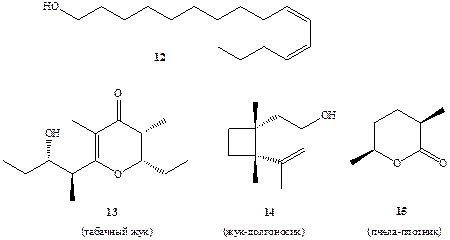 Схема 1.4
Схема 1.4
|
Половые аттрактанты многих других бабочек и мух тоже, как оказалось, имеют довольно простую структуру. Это, как правило, ациклические спирты с длинной не разветвленной цепью. Другие насекомые продуцируют в качестве половых феромонов соединения более сложной структуры, некоторые из которых (13-15) показаны на схеме 1.4 [12].
Массированные атаки насекомых могут приводить не только к полной гибели конкретного растения, но и катастрофическому опустошению лесов и полей и уничтожению продовольственных запасов на складах. Эти атаки обычно провоцируются феромонами агрегации, которые испускаются особями, обнаруживающими запасы пищи. Вот какова, например, схема (конечно, очень упрощенная!) такой атаки, используемая жуком-лубоедом Dendroctonus brevicomis — вредителем сосновых лесов. Самка этого жука, найдя подходящее дерево, затем приапекает к себе самцов с помощью атграктанта, в роли которого выступает брсвикомин (16, схема 1.5). Освоивши дерево, «колонизаторы» начинают выделять смесь феромонов, в состав которой входят изопреноиды 17—19, что воспринимается находящимися вблизи особями как приглашение «разделить обильное угощение». В конечном результате популяция вредителей быстро увеличивается в сотни раз и обреченное дерево вскоре погибает [12].
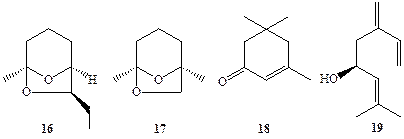 Схема 1.5
Схема 1.5
|
Функционирование канала химической информации особенно важно для поддержания жизнедеятельности коллективных насекомых. Почти идеальный порядок социальной жизни пчелиного улья поддерживается до тех пор, пока пчелиная матка сохраняет способность вырабатывать довольно простое соединение, (Е)-8-оксодсцен-2-овую кислоту (20) («королевское вещество») (схема 1.6) [13а,b]. Это вещество является химическим сигналом, выполняющим функцию многоцелевого регулятора. Во-первых, он служит половым аттрактантом для самцов, что обеспечивает постоянную возможность воспроизведения обитателей улья, а во-вторых, он, по-видимому, является чрезвычайно желанным «деликатесом» для остальных членов пчелиного семейства, которые не упускают случая им полакомится. Однако в результате такого «угощения» подавляется как репродуктивная функция других самок, так и их инстинкт к строительству ячеек большего размера, необходимых для выкармливания новой матки. Благодаря этому в улье в принципе невозможны ни «государственный переворот», ни даже появление нового «претендента на власть» до тех пор, пока матка остается дееспособной, т. е. сохраняет способность вырабатывать королевское вещество 20.
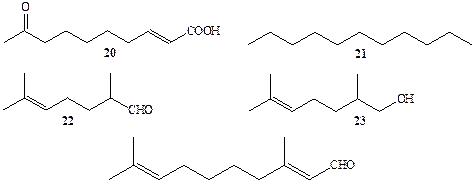 Схема 1.6
Схема 1.6
|
Строгая иерархия муравьиной колонии жестко определяет место и специализацию каждого из ее членов. Примечательные способности муравьев в организации «коллективных работ», таких, как сооружение муравейника, походы за пищей или с целью захвата «рабоп», культивация грибов или содержание тлей в качестве «домашних животных», не могут не вызывать восхищения. Накоплено множество данных, позволяющих утверждать, что одним из основных инструментов в организации подобного рода согласованных действий членов муравьиного сообществ является коммуникация между отдельными особями с использованием химического канала связи. Химические сигналы являются медиаторами на уровне как «вертикальных», так и «горизонтальных» связей. Например, так называемые кастовые феромоны, вырабатываемые маткой муравейника, определяют будущую специализацию молодой особи — «работника» или «воина», В последнем случае, кроме мощных челюстей, особь наделяется также способностью вырабатывать феромон тревоги. Попадание в среду этого феромона даже в незначительном количестве немедленно вызовет цепную реакцию его выделения другими «солдатами», происходит многократное усиление сигнала тревоги, и в течение нескольких секунд колония муравьев полностью приводится в состояние боевой готовности. При других условиях феромон тревоги может также провоцировать состояние паники и даже бегства всей колонии, С помощью других сигналов, феромонов агрегации, «работники» сообщают о необходимости включиться в строительство в определенном месте. Задачей некоторых «солдат» является разведка новых источников пищи и обнаружение целей для «грабежа». Естественно, что выполнение этой задачи требует использования феромонов, маркеров следа, причем эти сигналы должны быть достаточно специфичны, чтобы сообщения были понятны лишь членам данного семейства. Как правило, довольно простые по структуре вещества и их смеси используются муравьями в качестве химических сигналов. Так, например, в роли феромонов тревоги ряд видов муравьев использует набор веществ типа 20-24 (схема 1.6) в варьируемых соотношениях [14].
 Схема 1.7
Схема 1.7
|
Необыкновенно разнообразен набор природных веществ, продуцируемых низшими растениями. Биологические функции большинства из них просто неизвестны. Однако и для низших растений показано, что многие метаболиты выполняют функции медиаторов взаимоотношений между индивидуальными особями.
Интересно, что первые догадки о наличии таких химических сигналов высказывались наблюдательными натуралистами еще в середине XIX в. Так, в 1858 г. было предположено, что в цикле полового размножения морской водоросли Fucus serratus мужские половые клетки (андрогаметы) сближаются с женскими половыми клетками (гиногаметами) благодаря наличию в среде химических сигналов (хемотаксис) [15а]. Прошло более 100 лет, прежде чем удалось доказать справедливость предположения о роли продуцируемых и испускаемых в среду химических веществ как важнейших медиаторов в половом размножении. Оказалось, что для этой водоросли таким медиатором является триеновый углеводород фукозосерратен, C8H12 (25, схема 1.7), который продуцируется женскими половыми клетками и при попадании в водную среду служит половым аттрактантом для андрогамст. Подобный механизм широко используется и другими видами низших растений. Структуры 26—28 [15а,b] наглядно иллюстрируют, насколько разнообразные по строению углеводороды могут продуцироваться разными организмами для выполнения одной и той же функции.
Разумеется, все эти углеводороды практически нерастворимы в воде, что делает еще более интересным факт их фантастически высокой эффективности. Так, установлено, что положительный отзыв на сигнал может наблюдаться уже при пороговой концентрации 6,5 • 10-12 моль/л. Расчет показал, что для привлекающего эффекта достаточно, чтобы на одну андрогамету приходилось от одной до десяти молекул феромона [15а].
Для женских гамет некоторых видов гриба рода алломицетов Allomyces, обитающих в пресных водах, оказалось почему-то предпочтительнее вырабатывать в качестве полового аттрактанта сссквитерпен сиренин (29) [16]. Интересная последовательность событий, каждое из которых контролируется соответствующими экзогормонами. наблюдалась в цикле полового размножения морской водоросли Achliabisexualis. В этом процессе само формирование мужских и женских органов, предшествующее акту размножения, происходит в результате обмена сигналами, выделяемыми в среду. Интересно, что одним из веществ, используемых как сигнал в этих «переговорах», является стероид антеридиол (30) [17]. Этот, казалось бы частный, факт на самом деле является примечательным прежде всего потому, что он относится к числу свидетельств, пока еще немногочисленных, указывающих на то, что стероиды могут выполнять не только функции регуляторов жизнедеятельности внутри данного организма (эндогормоны), но также служить регуляторами взаимоотношений на межорганизменном уровне (экзогормоны).
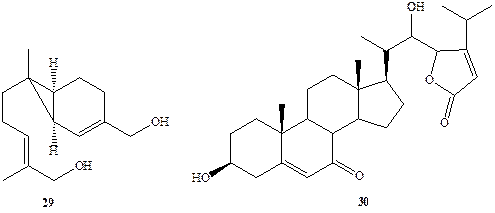 Схема 1.8
Схема 1.8
|
Факты, свидетельствующие о сложных, а подчас даже таинственных, взаимоотношениях между различными организмами, образующими биоценоз, известны с давних времен. Во многих случаях было также очевидно, что эти взаимоотношения каким-то образом связаны с химическими веществами, выделяемыми в среду. Однако лишь сравнительно недавно стали накапливаться строгие экспериментальные данные, свидетельствующие о существовании химического канала обмена информацией между особями разных видов. Здесь мы находимся еще в самом начале пути к пониманию всей картины взаимоотношений. Тем не менее ряд приводимых ниже фактов достаточно четко показывают важность функционирования химической сигнальной системы для жизни биологических сообществ.
Семена растения-паразита Striga asiatica (witch-weed, «всдьмин сорняк») могут находиться в почве в состоянии спячки до 20 лет, но они немедленно начинают прорастать, как только поблизости от них появляются корни растения-хозяина. Этот факт не является просто еще одним примером из огромного списка любопытных биологических феноменов. Дело в том, что растение-хозяин — это рис, сорго, а также ряд других злаков, и поэтому засоренность посевов этих культур таким сорняком может нанести огромный ущерб урожаю, от которого зависит жизнь миллионов людей. Каким же образом семена растения-паразита «узнают» о том, что рядом находятся прорастающие семена злака, и как выбирают правильное направление роста с тем, чтобы в конце концов прикрепиться к корням растения-хозяина?
Изучение этой проблемы показало, что прорастание семян сорняка провоцируется химическими веществами, вырабатываемыми растущими корешками растения-хозяина, и эти вещества служат факторами прорастания для семян растения-паразита.
Одним из таких стимуляторов роста оказался терпеноид стригол (31, схема 1.9) [18а]. Естественно было предположить, что предпосевная обработка полей этим соединением будет вызывать прорастание семян сорняка и тем самым откроет возможность радикального решения проблемы борьбы с ним. Неудивительно поэтому, что многочисленные исследования были направлены на разработку удобного метода синтеза соединения 31 и его более простых аналогов [18Ь]. Впоследствии было обнаружен еще один активный стимулятор прорастания семян растения-паразита, также вырабатываемый растущими семенами злаков рода Sorghum, а именно замещенный гидрохинон 32 [ 18с]. Подобно другим гидрохинонам вещество 32 способно легко претерпевать окисление, давая хинон 33, и этот процесс легко протекает в почве. Хинон 33 не является стимулятором прорастания семян сорняка, и поэтому прорастание последних может произойти лишь в том случае, если семя растения-паразита находится на достаточно близком расстоянии к растущему корешку растения-хозяина, поскольку в противном случае стимулятор 32 успеет полностью превратиться в неактивный 33 в ходе диффузии через почву. С «точки зрения» растения-паразита, это, конечно, очень удобный механизм, поскольку длина его растущих корешков не превышает 3 мм, передвигаться в почве семена не могут, и поэтому им нет никакого смысла подвергаться активации на большем расстоянии. Вопрос о том, как и для чего растение-хозяин обзавелось столь самоубийственной способностью способствовать росту своего паразита, по-видимому, следует отнести к одной из многочисленных загадок эволюции.
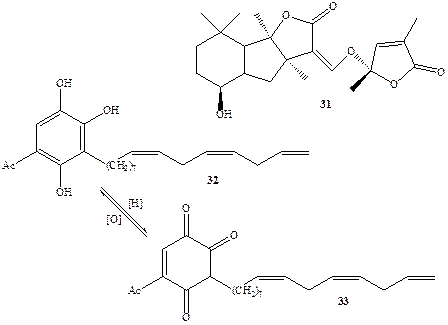 Схема 1.9
Схема 1.9
|
Теснейшая взаимосвязь между растениями и насекомыми — хорошо изученный биологический феномен, и накоплено множество фактов, указывающих на огромную роль химических веществ как регуляторов этих взаимоотношений [19]. Примерно полмиллиона видов насекомых кормится на растениях. В свою очередь, процессы репродукции множества растений критически зависят от переноса пыльцы, осуществляемого насекомыми. Поэтому неудивительно, что среди множества природных веществ, продуцируемых растениями, можно найти как атграктанты для «полезных» насекомых, так и репелленты или даже инсектициды для «вредных» [20]. Фантастическое разнообразие структур соединений, используемых для этих целей (среди них можно найти ациклические и полициклические соединения, в том числе изопренои-ды, ароматические и гетероароматические соединения, множество алкалоидов различного строения и т. д.) может служить прекрасной иллюстрацией того, насколько широки возможности Природы в выборе структур органических соединений, выполняющих те или иные функции. Однако надо сказать, что в общем имеется немного достоверных сведений о реальном механизме действия химических медиаторов со взаимоотношениях растений и насекомых.
 Схема 1.10
Схема 1.10
|
Один из интереснейших примеров, иллюстрирующих некоторые аспекты химических взаимоотношений между растениями и животными можно найти в работах группы Мейнвальда [21]. Алкалоиды (как и терпеноиды) относятся к числу так называемых вторичных метаболитов, т.е. веществ, не принимающих участия в основных циклах метаболизма. Эти азотсодержащие соединения в значительных количествах продуцируются различными растениями. Многие из этих соединений обладают ярко выраженной активностью по отношению животным (общеизвестна активность, например, морфина или стрихнина), но роль большинства алкалоидов в обеспечении жизнедеятельности организма-продуцента пока совершенно неизвестна. Сравнительно недавно было установлено, что во многих случаях они выполняют функции защиты растения от поедания насекомыми (антифиданты). Однако эта защита, как правило, оказывается не универсальной, поскольку в ходе эволюции некоторым видам насекомых удалось выработать устойчивость по отношению к этим ядам, а иные «ухитрились» разработать довольно изощренную схему использования потребляемых с пищей алкалоидов в своей жизнедеятельности. Так, например, личинки бабочки Utetheisa omatrix способны поедать листву растения семейства Crotolaria, поглощая при этом в довольно больших количествах ядовитые пирролизидиновые алкалоиды, в том числе монокротоналин (34, схема 1.10). Как было обнаружено, такая диета дает дополнительнътс преимущества для выживания вида, поскольку накопление 34 делает несъедобными и личинки, и взрослые особи для таких экгомофагов, как пауки или птицы [21]. Во взрослых организмах U. ornatrix 34частично превращается в другой алкалоид гидроксиданаидаль (35), который также обладает свойствами антифиданта для энтомофагов, являясь в то же время составной частью секрета, продуцируемого самцами бабочки в качестве аттрактанта. Чем больше содержится этого вещества в секрете, тем выше шансы у самца найти партнера для спаривания. Причина подобного Предпочтения довольно понятна: высокое содержание 35 в аттрактанте гарантирует высокое содержание 35 в семени самца, и, следовательно, значительная часть этого вещества будет перенесена в отложенные яички, которые благодаря этому станут несъедобными для таких врагов, как божьи коровки. Эволюционные преимущества подобной «заботы» о потомстве очевидны. У читателя может возникнуть вполне законный вопрос: зачем в книге, посвященной органическому синтезу, рассматривать примеры, хотя и интересные, но скорее относящиеся к общей биологии? Для нас самый главный вывод из рассмотренных выше примеров (а их число легко многократно УМНОЖИТЬ) состоит в том, что при решении вопроса о биологической активности или функции того или иного природного соединения нельзя ограничиваться только рассмотрением его возможных функций в организме-проду-Пенте или его свойства как потенциально полезного лекарства. На самом деле адекватное рассмотрение этой проблемы требует системного подхода, учитывающего сложность взаимоотношений внутри биологических систем На всех уровнях организации — от клеток до биоценозов.
Рассмотренные выше примеры относятся к довольно простым случаям, когда химические вещества служат медиаторами простых и хорошо определенных взаимоотношений внутри организма или между немногими особями. На самом деле взаимоотношения между биологическими партнерами образуют сложно переплетенную сеть горизонтальных и вертикальных связей, охватывающих псе сообщество. Стабильность интегрированной биологической системы как единого целого критически зависит от взаимодействия отдельных ее частей. Есть все основания предполагать, что химический канал связи в действительности является одной из важнейших составных частей системы контроля, обеспечивающего эффективность этого взаимодействия, хотя до сих пор мы не имеем целостного предстаачения о системе химической коммуникации в сколько-нибудь сложных биологических сообществах.
Очевидно, что знание языка химической коммуникации (словаря сигналов) и его синтаксиса совершенно необходимо для установления разумных и взаимополезных отношений человека с окружающей живой природой. Это позволит нам остановить, наконец, бесконечные и бессмысленные войны с Природой в попытках истребить «вредные для человека» виды и перейти к диалогу на универсально понятном языке химических сигналов и, следовательно, к разумной регуляции наших отношений с другими живыми существами. Это, конечно, не более чем очень далекая перспектива, но сама возможность движения в этом направлении во многом зависит от успехов органического синтеза.
В заключение раздела отмстим еще, что название раздела «Цель однозначна, но не бесспорна», конечно, достаточно приблизительно. Когда речь идет о синтезе природного соединения, то, даже если неизвестно, для каких целей оно синтезируется живым организмом и отсутствуют данные о его биологической активности, сам факт выделения такого соединения из природных источников делает бесспорной необходимость его лабораторного синтеза. Подобная категоричность может, конечно, вызвать множество возражений, но вся история развития химии природных соединений представляет множество свидетельств в пользу справедливости этого тезиса. В подтверждение приведем лишь один пример,
В 1968 г. из культуры гриба Pseudorotium avails был выделен сесквитерпен (—)-овалицин (36, схема 1.11). Хотя этот метаболит проявлял ряд свойств антибиотика, он не казался перспективным в качестве лекарственного средства и, как это бывает достаточно часто, не имелось абсолютно никаких данных о его возможной роли в жизнедеятельности организма-продуцента. Тем не менее, необычность и сложность строения этого соединения не могли не вызвать у синтетиков амбициозного желания синтезировать эту структуру. Синтез рацемического 36 был выполнен Кори в 1985 г. [22а], и одной из его целей была просто проверка предлагаемых общих принципов методологии органического синтеза. Схема синтеза включала последовательность большого числа стадий и, конечно, не предполагала возможности какого-либо практического использования.
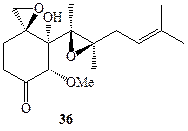 Схема 1.11
Схема 1.11
|
Совершенно неожиданно через 10 лет было обнаружено, что родственные соединению 36 метаболиты грибов обладают сильнейшим действием как ингибиторы образования новых кровеносных сосудов (ангиогснеза) и могут быть полезными как противоопухолевые лекарственные средства. Эти данные побудили Кори провести тесты на эту же активность для природного энантиомера (—)-36, в результате которых было установлено, что это соединение более активно и менее токсично, чем изученные ранее метаболиты '• сходного структурного типа. Этот результат, естественно, заставил снова обратиться к проблеме полного синтеза соединения 36, и ранее описанная процедура была значительно упрощена и приспособлена для получения требуемого энантиомерно чистого {—)-овалицина [22Ь].
Дата добавления: 2015-04-05; просмотров: 898;
