Газ в силовом поле. Барометрическая формула. Распределение Максвелла – Больцмана. Экспериментальное определение числа Авогадро.
Хаотическое движение молекул приводит к тому, что молекулы газа равномерно распределяются по объему сосуда. Это справедливо если на молекулы не действуют внешние силы. При наличии таких сил тепловое движение приводит к неоднородному распределению молекул по объему.
Рассмотрим газ, который находится под действием силы тяжести. Если бы отсутствовало тепловое движение молекул, то под действием силы тяжести весь воздух собрался бы тонким слоем на поверхности земли. Если бы отсутствовала сила тяжести, но осталось бы тепловое движение молекул, то они разлетелись бы по всему мировому пространству. Атмосфера Земли существует благодаря наличию одновременно и теплового движения молекул и силы притяжения к Земле. Поэтому в атмосфере устанавливается определенное распределение молекул и соответственно давления газа по высоте.
Рассмотрим вертикальный слой воздуха с основанием dS (рис.1).
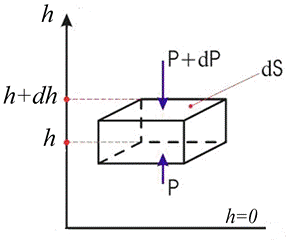
Рис.1. К выводу барометрической формулы
Пусть у поверхности земли, где h = 0, давление равно pо. Атмосферное давление p на высоте h обусловлено действием силы тяжести слоев воздуха, которые лежат выше. Давление на высоте h + dh будет равно p + dp, причем, если dh > 0, то dp < 0, так как давление с увеличением высоты уменьшается.
Разность давлений p и p + dp равна давлению газа, которое создает сила тяжести, действующая на газ, находящийся в объеме с площадью dS и высотой dh
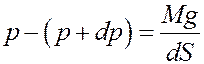 (1)
(1)
где M – масса газа, Mg – сила тяжести, действующая на газ, находящийся в рассматриваемом объеме.
Очевидно:
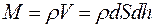 (2)
(2)
где ρ – плотность газа на высоте h, V - объем газа.
С учетом (2) из (1) получим:
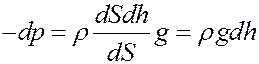 (3)
(3)
(в формуле (3) ρgdh – гидростатическое давление столба газа высотой dh)
Плотность газа равна произведению массы одной молекулы m на их число в единице объема, т.е. на концентрацию n:
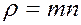 (4)
(4)
Из основного уравнения МКТ получим:
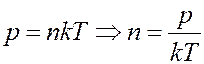 (5)
(5)
С учетом (5) из (4) получим:
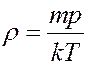 (6)
(6)
Учитывая (6) перепишем (3) в виде:
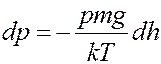 (7)
(7)
В (7) разделим переменные:
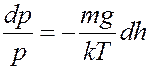 (8)
(8)
Если считать, что на всех высотах температура одинаковая T = const (что, вообще говоря, не совсем верно), то после интегрирования (8) получим:
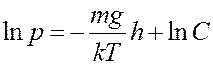 (9)
(9)
где C – постоянная интегрирования. Ее можно определить из начальных условий: если h = 0, то p = po. С учетом этого из (9) получим: C = po. Тогда:

Отсюда следует, что
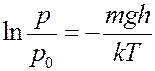
После потенцирования получим:
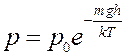 (10)
(10)
С учетом того, что
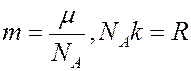
Получим:
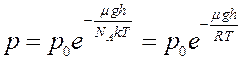 (11)
(11)
где μ – молярная масса, NA – число Авогадро, R – универсальная газовая постоянная.
Уравнения (10) и (11), выражающие закон изменения давления с высотой, называются барометрической формулой. Из этих уравнений видно, что давление уменьшается с высотой по экспоненциальному закону.
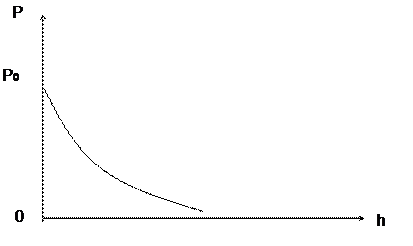
Pис.2. Зависимость атмосферного давления от высоты
Формулы (10) и (11) справедливы для высот 10 – 15 км, где на изменение ускорения силы тяжести с высотой можно не обращать внимания. В случае смеси нескольких газов эти формулы справедливы для парциального давления каждого газа. В соответствии с (11), чем больше молярная масса газа, тем быстрее его давление уменьшается с высотой. Следовательно, атмосфера земли должна обогащаться легкими газами с ростом высоты. Однако из-за перемешивания (ветер, конвекционные потоки) до высот 80 – 90 км атмосфера практически однородна. И только на высотах более 90 км состав атмосферы обогащен легкими газами.
С помощью барометрической формулы, зная давление p на данной высоте и давление на уровне моря po можно определить высоту над уровнем моря. Приборы, которые применяются для этих целей, представляют собой специальные барометры, шкала которых проградуирована в метрах. Они называются альтиметрами.
Известно, что:
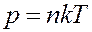
С учетом этого из (10) получим
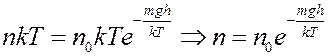 (12)
(12)
где no – концентрация молекул на высоте h = 0, n – концентрация молекул на высоте h.
Из (12) следует, что при T→∞, n→no. Это значит, что при повышении температуры газа, его молекулы стремятся равномерно распределиться по высоте. Если T→0, то и n→0. Следовательно, при абсолютном нуле температуры молекулы газа должны разместиться на поверхности земли. Из вышесказанного вытекает, что распределение молекул по высоте устанавливается в результате взаимодействия двух факторов: 1). Притяжения молекул к земле, которое характеризуется силой тяжести mg, стремится расположить их на поверхности земли, 2). Тепловое движение молекул, которое характеризуется величиной kT, стремится распределить их равномерно по всему пространству.
В (12) mgh = Eп – потенциальная энергия молекулы на высоте h. Поэтому (12) по сути дела, является распределением молекул по значениям потенциальной энергии.
 (13)
(13)
где n0 – концентрация молекул в том месте, где их потенциальная энергия равна нулю, n – концентрация молекул в том месте, где их потенциальная энергия равна Eп.
Из (13) следует, что концентрация молекул максимальнав том месте, где их потенциальная энергия минимальна и наоборот.
Согласно (13) отношение концентраций молекул n1 и n2 в местах, где их потенциальная энергия равна соответственно Eп1 и Eп2 определяется соотношением:
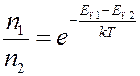 (14)
(14)
Очевидно, что поведение газа не изменится, если вместо силы тяжести на газ будет действовать другая консервативная сила, а выражение для потенциальной энергии будет иметь другой вид. Больцман показал, что формула (13) справедлива для газа, или любых других частичек, двигающихся хаотично и находящихся в любом потенциальном поле сил. Поэтому распределение (13) называется распределением Больцмана.
Закон Максвелла определяет распределение молекул по значениям их кинетической энергии (по скоростям), а закон Больцмана распределение молекул по значениям потенциальной энергии. Для этих распределений характерно наличие экспоненциального множителя, в показателе которого стоят отношения кинетической (Максвелл) или потенциальной (Больцман) энергии к величине пропорциональной средней энергии теплового движения молекул (kT).
Эти распределения можно объединить в один закон - распределение Максвелла–Больцмана. Если в формулу распределения Максвелла подставить n из (13), то получится распределение Максвелла–Больцмана:
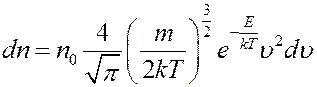 (15)
(15)
где

полная энергия молекулы в потенциальном поле сил, no - концентрация молекул в том месте, где их потенциальная энергия равна нулю, dn - концентрация молекул, которые обладают скоростями от υ до υ+dυ и потенциальной энергией Eп. Кинетическая энергия молекул зависит от скорости, потенциальная энергия зависит от их координат. Следовательно, распределение Максвелла–Больцмана одновременно учитывает, как и вероятность данного значения энергии, так и вероятность данного положения (координат) молекулы в потенциальном поле сил.
Распределение Больцмана легло в основу опытов Перрена по определению числа Авогадро и постоянной Больцмана. Броуновские частички ведут себя подобно большим молекулам. Следовательно, на них должно распространяться распределение Больцмана, т.е. броуновские частички в поле силы тяжести должны распределяться по высоте по закону (13).
Перрен изготовил эмульсию, содержавшую частички практически одинакового размера. Эмульсия помещалась в плоскую кювету, глубиной ~ 0,1 мм и рассматривалась через короткофокусный микроскоп (рис.3).
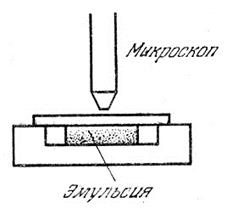
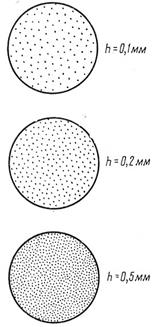
Рис.3. Схема опыта Перрена.
Микроскоп имел такую малую глубину резкости, что позволял наблюдать только те частицы, которые находились в слое толщиной ~ 1мкм = 10-6м. Перемещая микроскоп по вертикали можно было исследовать распределение частичек по высоте (рис.3). Число частичек, которые попали в поле зрения, очевидно, пропорционально их концентрации n. Тогда закон Больцмана для броуновских частичек имеет вид:
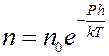
где no – концентрация частичек на высоте h = 0, n – концентрация частичек на высоте h, P – вес частички в эмульсии (с учетом силы Архимеда). Для двух разных высот h1 и h2 получим:
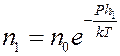 ,
, 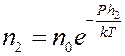
Отсюда:
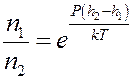
Прологарифмируем последнее уравнение:
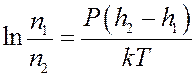
Отсюда:
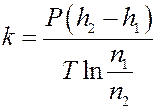
где
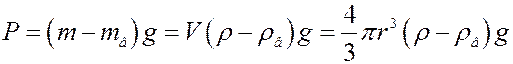
Окончательно:
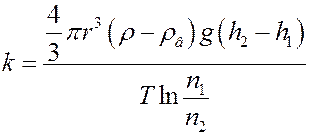
где ρ – плотность частички, ρв – плотность жидкости, r – радиус частички.
Определив r, ρ, и ρв, число частичек n1 и n2 на высотах h1 и h2 и, зная температуру можно рассчитать значение постоянной Больцмана и числа Авогадро (NА = R/k).
Полученное Перреном значение NА находилось в пределах (6,5 – 7,2)·1023 моль-1. Другие ученые, используя этот же метод, получили более точное значение NА:
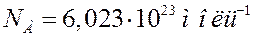 .
.
Дата добавления: 2015-05-21; просмотров: 2231;
