Стандартная энтропия. Изменение энтропии при протекании химической реакции.
Энтропию, как и другие термодинамические функции, принято относить к стандартному состоянию вещества.
Напомним, что стандартное состояние характеризуется стандартными условиями: давлением Р0 и составом (мольная доля x0). В качестве основного стандартного состояния для всех газообразных веществ определено чистое вещество (х0 = 1) в состоянии идеального газа с давлением Р0 = 1 атм. (1,01325 · 105 Па или 760 мм рт.ст.) при любой фиксированной температуре. Для твердых и жидких веществ основное стандартное состояние - это состояние чистого вещества (х0 = 1), находящегося под внешним давлением Р0 = 1 атм.
Это означает, что вычисление стандартной энтропии ( 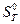 ) требует внесения поправки на изменение давления при переходе системы от состояния, характеризующегося значением энтропии
) требует внесения поправки на изменение давления при переходе системы от состояния, характеризующегося значением энтропии 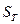 и параметрами Р и Т, к состоянию Р0 и Т.
и параметрами Р и Т, к состоянию Р0 и Т.
Из уравнения (II,19) и теоремы 1 следует:
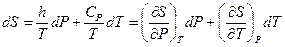 (II,29)
(II,29)
Следовательно, 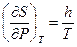 или, принимая во внимание (I,39) и уравнение Менделеева-Клапейрона,
или, принимая во внимание (I,39) и уравнение Менделеева-Клапейрона, 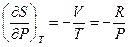
Т.к. T=const, частную производную можно заменить на полную:
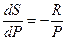 и
и 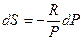 , тогда
, тогда 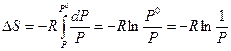
Тогда окончательно имеем:
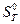 =
= 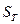
 (II,30)
(II,30)
Стандартную энтропию вещества 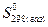 также можно вычислить, если известна его энтропия в жидком или твердом состоянии при указанной температуре. Это делают по уравнениям:
также можно вычислить, если известна его энтропия в жидком или твердом состоянии при указанной температуре. Это делают по уравнениям:
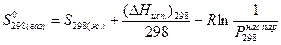
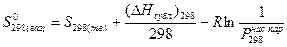 ,
,
где 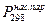 (атм.) - давление насыщенных паров над веществом в жидком или твердом состоянии при 298 К,
(атм.) - давление насыщенных паров над веществом в жидком или твердом состоянии при 298 К,  - теплота испарения,
- теплота испарения, 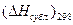 - теплота сублимации.
- теплота сублимации.
Известные значения стандартной энтропии веществ дают возможность вычислить 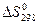 химической реакции:
химической реакции:
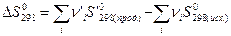
При произвольной температуре Т  реакции вычисляют по формуле:
реакции вычисляют по формуле: 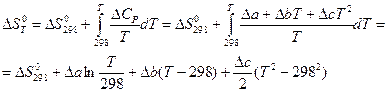 (II,31)
(II,31)
Дата добавления: 2015-05-21; просмотров: 1324;
