Функций для расчетов равновесий.
Этот метод расчета широко используется для вычисления энергетических эффектов химических реакций, констант равновесия химических реакций и т. д. Главное достоинство метода состоит в том, что та часть вычислений, которая требует много времени и является источником наибольших ошибок, сделана единожды и с возможно большей точностью. То, что остается вычислить сверх табличных данных носит большей частью характер поправок, нахождение которых не требует высокой точности и допускает использование разумных приближений.
Обычные таблицы содержат величины:
- изменения энтальпии при образовании одного моля вещества в стандартных условиях ( 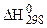 );
);
- изменения энергии Гиббса образования одного моля вещества в стандартных условиях ( 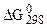 );
);
- абсолютных значений энтропии, в расчете на 1 моль вещества в стандартных условиях ( 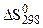 );
);
За стандартные условия принято считать температуру 25 0С и давление 1,01  105 Па.
105 Па.
Все подсчеты по таблицам основаны на свойствах аддитивности G, H и S, поэтому сводятся к простому алгебраическому суммированию. аналогичному расчетам по закону Гесса. Так, изменение энтальпии реакции 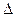 Н равно алгебраической сумме изменений энтальпий образования продуктов реакции. Это относится к
Н равно алгебраической сумме изменений энтальпий образования продуктов реакции. Это относится к 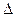 G и
G и 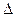 S реакции. При этом следует иметь в виду, что
S реакции. При этом следует иметь в виду, что 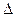 Н и
Н и 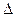 G простых веществ равны нулю, поэтому в таблицах не приводятся.
G простых веществ равны нулю, поэтому в таблицах не приводятся.
Таблицы термодинамических функций в стандартных условиях позволяют рассчитать 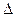 G,
G, 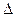 H и
H и 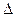 S реакции только в стандартных условиях. Для нахождения этих величин при любой температуре учитывается их зависимость от температуры.
S реакции только в стандартных условиях. Для нахождения этих величин при любой температуре учитывается их зависимость от температуры.
Например для расчета энергетического эффекта химической реакции используется уравнение Кирхгофа:
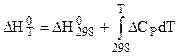 , (5.16)
, (5.16)
где 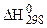 - изменение энтальпии реакции при Т = 298 К;
- изменение энтальпии реакции при Т = 298 К;
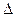 СР - алгебраическая сумма теплоемкостей продуктов реакции;
СР - алгебраическая сумма теплоемкостей продуктов реакции;
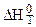 - изменение энтальпии реакции при температуре Т, причем
- изменение энтальпии реакции при температуре Т, причем 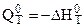 .
.
Для определения изменения энтропии реакции используется выражение;
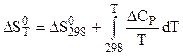 , (5.17)
, (5.17)
где 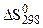 - изменение энтропии реакции при Т = 298 К;
- изменение энтропии реакции при Т = 298 К;
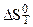 - изменение энтропии реакции при температуре Т.
- изменение энтропии реакции при температуре Т.
Если уравнения (5.16) и (5.17) ввести в уравнение:
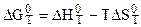 ,
,
то получается:
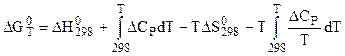 ,
,
или
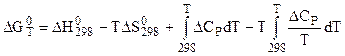 . (5.18)
. (5.18)
По величине 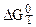 согласно уравнению стандартного сродства -
согласно уравнению стандартного сродства - 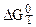 = RTlnkP можно рассчитать величину kP для любой температуры:
= RTlnkP можно рассчитать величину kP для любой температуры:
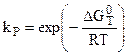 . (5.19)
. (5.19)
Уравнения (5.18) и (5.19) позволяют вычислять 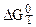 и kP из термохимических данных. В зависимости от характера возникающих практических вопросов в использовании метода расчета вносятся изменения, упрощающие или уточняющие расчеты.
и kP из термохимических данных. В зависимости от характера возникающих практических вопросов в использовании метода расчета вносятся изменения, упрощающие или уточняющие расчеты.
Следует заметить, что ряд важнейших технологических процессов металлургической практики основан на результатах подобных и аналогичных расчетов. Более того, физическая химия металлургических процессов основана на использовании этих расчетов для анализа схем получения металлов и их сплавов из руд.
Приближения Улиха.
Первое приближение заключается в том, что 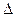 СР = 0, т. е. считается, что протекающая реакция не сопровождается изменением теплоемкости системы. Тогда уравнение (5.18) принимает вид:
СР = 0, т. е. считается, что протекающая реакция не сопровождается изменением теплоемкости системы. Тогда уравнение (5.18) принимает вид:
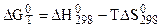 . (5.20)
. (5.20)
Второе приближение используется тогда, когда нет возможности возпользоваться температурной зависимостью теплоемкости. В этом случае 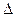 СР = а, где а выбирается на основе приблизительной оценки теплоемкостей при комнатной температуре.
СР = а, где а выбирается на основе приблизительной оценки теплоемкостей при комнатной температуре.
Обычно итоговое уравнение для расчета таково:
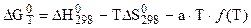 , (5.21)
, (5.21)
где
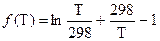 .
.
Метод Темкина - Шварцмана.
Если 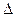 СР химической реакции задано степенным рядом вида:
СР химической реакции задано степенным рядом вида: 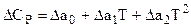 ,
,
то
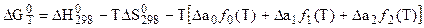 , (5.22)
, (5.22)
где функции f0(T), f1(T) и f2(T) определяются при любой температуре с помощью специальных таблиц. В этом методе расчета его облегчение достигнуто за счет предварительного табулирования всех температурных функций, входящих в уравнение для определения логарифма константы равновесия химической реакции.
Владимировым Л.П. были предложены два новых метода простого и быстрого расчета химических равновесий. Первый автором назван приближенным, а второй - точным.
В соответствии с приближенным методом расчета для любой химической реакции имеет место простое выражение:
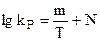 , (5.23)
, (5.23)
где m и N - численные функции от 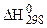 и
и 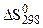 .
.
Особенность точного метода расчета состоит в том, что необходимые для расчета функции заранее вычисляются для простейших соединений, образующихся из элементов. Это дает возможность вычислять логарифм констант равновесия любых сложных реакций путем алгебраического сложения соответствующих каждому реагенту заранее вычисленных функций.
Расчет значений логарифмов констант равновесия газовых реакций этим методом производится по вытекающей из точной формулы:
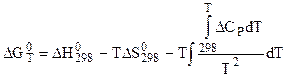
упрощенной формуле:
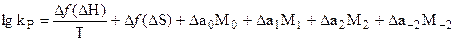 , (5.24)
, (5.24)
каждый член которой представляет алгебраическую сумму соответствующих реагентам одной из вышеупомянутых функций ( 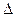 H,
H, 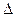 S и
S и 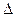 СР). Это позволяет производить расчет в более удобной форме.
СР). Это позволяет производить расчет в более удобной форме.
Функции 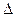 f (
f ( 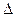 H) и
H) и 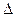 f (
f ( 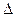 S) определяются с помощью специальных таблиц как и М0, М1, М2, М-2.
S) определяются с помощью специальных таблиц как и М0, М1, М2, М-2.
Дата добавления: 2015-05-21; просмотров: 1392;
