Следствия из тепловой теоремы Нернста.
I следствие. Производная  в соответствии с уравнением Кирхгофа (3.26) равна алгебраической сумме теплоемкостей составных частей системы. Но
в соответствии с уравнением Кирхгофа (3.26) равна алгебраической сумме теплоемкостей составных частей системы. Но 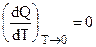 , поэтому:
, поэтому:
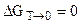 . (5.9)
. (5.9)
Это означает, что при абсолютном нуле для конденсированных систем строго соблюдается правило Неймана - Коппа об аддитивности теплоемкостей.
Нернст пошел дальше и доказал, что не только алгебраическая сумма всех теплоемкостей равна нулю (5.9), но и теплоемкость каждого в отдельности конденсированного тела равна нулю:
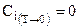 . (5.10)
. (5.10)
Ранее в главе II показано, что этот вывод находится в согласии с опытом и что он следует из квантовой теории теплоемкости.
II следствие. Согласно тепловой теории Нернста 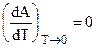 . Но
. Но 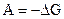 , a
, a  , поэтому:
, поэтому:
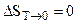 . (5.11)
. (5.11)
Условие (5.11) показывает, что при любых процессах с конденсированными телами при абсолютном нуле температуры энтропия не изменяется. Это равносильно тому, что энтропии всех конденсированных тел при Т 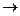 0 одинаковы. М. Планк (1912 г.), расширяя теорему Нернста, предложил, что и для каждого конденсированного тела в отдельности:
0 одинаковы. М. Планк (1912 г.), расширяя теорему Нернста, предложил, что и для каждого конденсированного тела в отдельности:
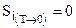 , (5.12)
, (5.12)
т. е. энтропия правильно образованного кристалла чистого вещества при абсолютном нуле температур равна нулю.
Формулировка М. Планка позволяет вычислять абсолютные значения энтропии, что открыло путь к широкому применению таблиц термодинамических функций для вычисления химических равновесий.
III следствие. Для того, чтобы найти величину const в уравнении (5.4) можно поступить следующим образом: уравнение 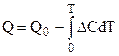 вводится в уравнение (5.3):
вводится в уравнение (5.3):
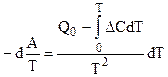 .
.
Интегрирование в пределах от 0 до Т дает:
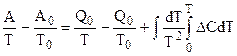
или
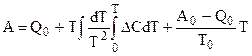 .
.
Полученное выражение идентично выражению (5.4), если положить, что 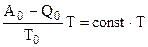 . Но согласно уравнению Гиббса - Гельмгольца ():
. Но согласно уравнению Гиббса - Гельмгольца ():
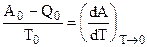 , где
, где 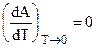 .
.
Поэтому:
const = 0, (5.13)
что устраняет неопределенность в интеграле уравнения Гиббса - Гельмгольца (5.4) и позволяет получить истинные значения А = f (Т) для конденсированных систем.
Теорема Нернста непосредственно к газовым равновесиям неприменима. Поэтому для них она не может дать численного значения const в уравнении Гиббса - Гельмгольца (5.4).
Однако косвенным путем она дает важные сведения. Оказывается, что величина const интегрирования в уравнении изобары химической реакции:
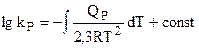
равна алгебраической сумме истинных химических постоянных продуктов химической реакци:
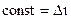 , (5.14)
, (5.14)
что позволяет вычислять химическое сродство при различных температурах для газовых равновесий.
Дата добавления: 2015-05-21; просмотров: 963;
